解:(1)要使产物纯净,必须物质间发生反应后,没有杂质生成.
a、氯气有氧化性,能氧化二价铁离子生成三价铁离子,但同时有氯离子生成,所以有杂质生成,故a错误;
b、铁与稀硫酸反应生成二价铁离子,不能把二价铁离子转化为三价铁离子,故b错误;
c、硝酸能氧化二价铁离子生成三价铁离子,但溶液中还有杂质硝酸根离子,故c错误;
d、双氧水能氧化二价铁离子生成三价铁离子,同时有水生成,水是原溶液的成分,所以不是杂质,故d正确;
故选d;
(2)a、合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,所以黄铜矿不是合金,故a错误;
b、CuFeS2中铁元素的化合价为+2价,反应物Fe3+的化合价为+3价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,故b错误;
c、CuFeS2中只有S元素的化合价只有升高,其他元素的化合价不变,所以CuFeS2只作还原剂,故c错误;
d、CuFeS2+4Fe3+=Cu2++5Fe2++2S 转移电子4
184g 4mol
46g 1mol
故d正确;
故选d;
(3)FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,该反应,FeSO4中Fe的化合价为+2价,K2FeO4中Fe的化合价为+6价,所以一个氯化亚铁分子失去4个电子;K2O2中O的化合价为-1价,O2中O的化合价为0价,一个K2O2分子失去2个电子生成氧气;K2O2中O的化合价为-1价,K2FeO4和K2O中O元素的化合价为-2价,所以一个K2O2失去2个电子,该方程式中得失电子的最小公倍数为6,所以该方程式的计量数分别为2、6、2、2、2、1,即方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案为:2、6、2、2、2、1;
(4)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒,故答案为:净水;消毒.
分析:(1)根据物质的性质及是否引进杂质确定选项;
(2)根据合金的定义、化合价的升降、发生反应的物质与转移电子之间的关系判断;
(3)根据得失电子数相等配平反应方程式,注意化合价的判断方法;
(4)利用离子的水解产物的性质来分析净水原因.
点评:本题考查了铁盐和亚铁盐的相互转化,难度不大,注意二价铁离子和三价铁离子的检验是高考的热点,三价铁离子能使KSCN变红色.

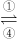 Fe3+
Fe3+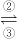 FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)

 灵星计算小达人系列答案
灵星计算小达人系列答案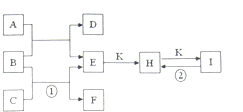 如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)
如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)