
【题目】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。

请回答下列问题:
(1)A中加入的物质是________,发生反应的化学方程式是______________________。
(2)B中加入的物质是________,其作用是_________________________________。
(3)实验时在C中观察到的现象是__________________________________,
发生反应的化学方程式是_________________________________________。
(4)实验时在D中观察到的现象是________________________________________,
D中收集到的物质是________,检验该物质的方法和现象是________________。
【答案】(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(其他合理答案也可)
CaCl2+2NH3↑+2H2O(其他合理答案也可)
(2)碱石灰(或CaO) 除去氨气中的水蒸气
(3)黑色粉末逐渐变为红色 2NH3+3CuO![]() N2+3H2O+3Cu
N2+3H2O+3Cu
(4)出现无色液体 氨水 用红色石蕊试纸检验,试纸变蓝;用无水硫酸铜检验,无水硫酸铜变蓝
【解析】
试题分析:(1)由题意可知A装置应是制备氨气的装置,则A中加入的物质是固体NH4Cl和Ca(OH)2,反应的化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)在装置A中发生反应制取氨气,然后通过盛有碱石灰的干燥管B,得到干燥的氨气;
(3)在C中发生反应:2NH3+3CuO![]() N2+3H2O+3Cu,会看到黑色粉末逐渐变为红色;
N2+3H2O+3Cu,会看到黑色粉末逐渐变为红色;
(4)反应产生的水在D中被冷却为液态,未反应的氨气溶解在其中,所以在装置D中可收集到氨水,可以观察到出现无色液体,氨水呈碱性,则检验该物质的方法和现象是用红色石蕊试纸检验,试纸变蓝;用无水硫酸铜检验,无水硫酸铜变蓝。


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z 原子序数依次增大,它们的原子最外层电子数之和为 18。X 的核电荷数是 Z 的核电荷数的一半。W 的单质是空气中含量最多的气体。下列说法正确的是
A.Y位于元素周期表中第3周期ⅠB族
B.原子半径:r(W)<r(X)<r(Y)<r(Z)
C.同周期元素中Y的最高价氧化物对应水化物的碱性最强
D.W的气态氢化物的热稳定性比X的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一位厨师不小心把刚熬好的羊油碰翻在灶坑旁,与草木灰混在一起,当他将羊油与草木灰的混合物用手捧出去后,洗手时发现手洗得特别干净。对此下列解释正确的是
A.羊油是一种有机溶剂,溶解了厨师手上的油污
B.草木灰呈碱性,与羊油发生了中和反应,除去油污
C.羊油与草木灰中的物质发生了加成反应,除去油污
D.羊油在碱性草木灰(主要成分为K2CO3)的作用下发生了皂化反应,生成具有去油污能力的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。

步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。


步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的名称为 。
(2)步骤二中的仪器分析方法称为________。
(3)写出X与足量浓硝酸和浓硫酸混合物反应的化学方程式: 。
(4)写出X符合下列条件的同分异构体结构简式 。
①芳香烃 ②苯环上一氯代物有三种
(5)X以醋酸为溶剂在催化剂作用下用氧气氧化得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:25 ℃时0.25 g、50 ℃时0.97 g、95 ℃时7.17 g。得到的粗产品中有部分不溶性杂质,请简述实验室中提纯PTA的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年诺贝尔化学奖授予三位美国科学家,以表彰他们如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有________(不定项选择)。
a.每个C2H2和C2H4分子中的π键数目相同 b.碳负离子CH呈三角锥形
c. NO+电子式为 [∶NO∶]+ d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极,也可人工合成二价钒(V)固氮酶(结构如图)


V元素位于周期表的______区,该原子基态时的价层电子排布式为___________________。
②钒固氮酶中钒的配位原子有________(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如图所示,该晶胞中含有钒原子数目为________。
(3)烟酰胺(结构简式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有 ,1 mol该分子中含σ键的数目为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差。在上图右图中的锥形 瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )

A. Cu与稀盐酸 B. NaHCO3与NaOH溶液
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修化学与技术】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:____________。
(2)滤渣A的主要成分________;硅铝酸盐沉淀写成氧化物的形式是________。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 _。
(4)若该工厂用![]() kg铝土矿共制得
kg铝土矿共制得![]() kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(5)若将铝溶解,下列试剂中最好选用_____ __(填编号)。
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂, Na3AlF6是配合物,其中内界是___,配位数为_ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH可制备锂离子电池正极材料。LiOH可由电解法制备,如右图,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法错误的是

A.B极区电解质溶液为LiOH溶液
B.阳极电极反应式为2Cl--2e-=Cl2↑
C.电解过程中主要是H+通过阳离子交换膜向B电极迁移
D.电极A连接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[(Ca5(PO4)3F)]生产磷铵[(NH4)3PO4]并制取硫酸、联产水泥。其工艺流程如下图所示:
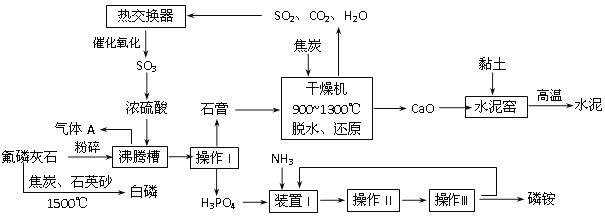
(1)操作I的名称________________;在实验室中操作II包括___________、____________。
(2)沸腾槽的材质是_______________(从“玻璃”、“钢铁”、“附有聚偏氟乙烯防腐层的石墨”中选择),选择的理由是__________________________________________________
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:_________________________________________。
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为____________。
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g) ![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
从化学反应原理的角度说明催化氧化时使用热交换器的原因__________________。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。
编号 | 试剂组 | 结论 |
① | NaOH溶液、酚酞试液 | |
② | Na2CO3溶液、酚酞试液 | |
③ | 碘水、淀粉溶液 | |
④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com