
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
分析 A.根据物料守恒分析;
B.NH4Cl溶液中氢离子全部由水电离;
C.Na2SO3溶液中加入少量NaOH固体,氢氧化钠抑制亚硫酸根离子的水解;
D.根据溶液的质子守恒分析.
解答 解:A.NaClO溶液中,钠元素的总浓度等于氯元素的总浓度,则溶液中物料守恒为:c(Na+)=c(ClO-)+c(HClO),故A错误;
B.NH4Cl溶液中氢离子全部由水电离,则常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1,故B正确;
C.Na2SO3溶液中加入少量NaOH固体,氢氧化钠抑制亚硫酸根离子的水解,溶液中c(SO32-)增大,加入NaOH溶液,c(Na+)也增大,故C正确;
D.Na2S稀溶液中,存在质子守恒,即:c(OH-)=c(H+)+2c(H2S)+c(HS-),故D正确.
故选A.
点评 本题考查了盐的水解、以及影响水解平衡的因素,题目难度不大,注意把握溶液中的物料守恒和质子守恒等守恒关系的应用,侧重于考查学生的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 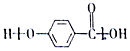 的结构中含有酯基 的结构中含有酯基 | |
| B. | 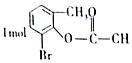 一定条件下与足量NaOH溶液反应,最多消耗3molNaOH 一定条件下与足量NaOH溶液反应,最多消耗3molNaOH | |
| C. | 按系统命名法,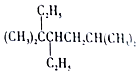 的名称为3,3,6-三甲基-4-乙基庚烷 的名称为3,3,6-三甲基-4-乙基庚烷 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| C. | 蛋白质、淀粉、纤维素都属于有机高分子化合物 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
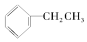 ⑤CH3COOCH3 ⑥
⑤CH3COOCH3 ⑥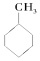
| A. | ②③⑤ | B. | ①⑤⑥ | C. | ①④⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-、Br-、CrO4- | B. | Br-、Cl-、CrO4- | C. | CrO4-、Br-、I- | D. | Br-、CrO4-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com