
| A. | 金属钠存放在盛有煤油的试剂瓶中 | |
| B. | 烧碱盛放在玻璃瓶塞的磨口玻璃瓶中 | |
| C. | 存放液溴的试剂瓶中应加水封 | |
| D. | 漂白粉置于冷暗处密封保存 |
分析 A.金属钠能与空气中的氧气和水反应;
B.玻璃的主要成分是二氧化硅;
C.液溴易挥发;
D.根据漂白粉的性质及HClO的性质来分析漂白粉需要密封保存在干燥的地方.
解答 解:A.因金属钠能与空气中的氧气和水反应,须贮存在煤油中隔离空气,故A正确;
B.因烧碱溶液能与玻璃中的二氧化硅反应生成具有粘和合性的硅酸钠,容易将瓶口和瓶塞粘结在一起,故烧碱溶液盛放在带橡皮塞的玻璃瓶中,故B错误;
C.因液溴易挥发,保存溴时应加入少量水,故C正确;
D.因碳酸的酸性大于次氯酸,则Ca(ClO)2能和空气中CO2、H2O发生反应生成HClO,且HClO光照或受热会发生分解,则漂白粉需要密封避光保存于阴凉处,故D正确.
故选B.
点评 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )| A. | x+y>z+m | |
| B. | 对反应体系加压v正>v逆 | |
| C. | 该反应正反应方向为热反应 | |
| D. | 对反应体系降低温度达平衡前v逆>v正 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在醋酸溶液中加入少量NaHSO4固体,醋酸的电离平衡左移,且溶液中的c(H+)减小 | |
| B. | 加热蒸干并灼烧硝酸铝溶液,最终得到的固体是Al(NO3)3 | |
| C. | 常温下,将 pH=1的醋酸溶液稀释1000倍,测得 pH=4 | |
| D. | 熵增加且放热的反应一定是自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 等物质的量浓度的NH3•H2O溶液和NH4Cl溶液等体积混合后所得的溶液中,2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+) | |
| C. | 等体积、等物质的量浓度的 Na2CO3溶液与 NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
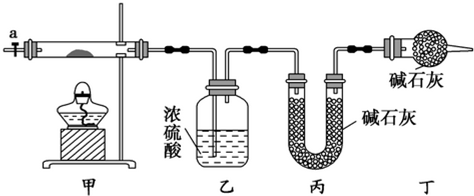

| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
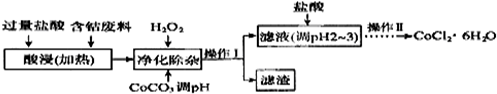
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
| 开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 标准状况下,0.5NA氟化氢分子所占体积是11.2L | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 12.4g白磷中含有磷原子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com