
现甲、乙两化学小组安装两套如下相同装置,用以探究影响H2O2分解速率的因素。
(1)仪器a的名称______;检查装置气密性的操作为______。
(2)MnO2催化下H2O2分解的化学方程式是______。
(3)甲小组有如下实验设计方案,请帮助完成(所有空均需填满)。
⑷甲、乙两小组得出如图数据。
①由甲组实验II得出的数据可知:浓度越大,H2O2分解速率______;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是______;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为______;支持这一方案的理由是____________。
(14分)(1)锥形瓶(1分)将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分流漏斗颈部能形成稳定的水柱,说明装置气密性良好,反之则气密性差。(或关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移,停止加热后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。或关闭分液漏斗活塞,用力将注射器活塞外移,停止用力后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。)(2分其他合理答案也给分)(2)2H2O2 2H2O+O2↑(2分)(3)
2H2O+O2↑(2分)(3) 探究浓度对速率的影响 3滴FeCl3溶液
(各1分,共2分)(4)①越快(1分)②K2O2(2分)BaO2+H2SO4=BaSO4↓+H2O2(2分)制备H2O2的环境为酸性环境,H2O2分解速率较慢(2分)
解析试题分析:(1)检查装置气密性可用加水法或加热法或抽气法。
(3)实验I和IIH2O2浓度不同,实验目的是探究浓度对速率的影响,所以II也只能加3滴氯化铁溶液。
(4)①由图像可看出甲组实验II斜率大,完全放出氧气所用时间少,反应速率快,所以过氧化氢浓度越大,反应速率越快。②碱性条件下过氧化氢分解速率比酸性条件下过氧化氢分解速率快,过氧化钾溶于水生成的KOH比过氧化钠溶于水生成的氢氧化钠碱性强,过氧化钠和过氧化钾溶于水放出氧气速率较快的是过氧化钾;过氧化钡与硫酸生成硫酸钡和过氧化氢,酸性条件下过氧化氢分解速率较慢,可以用该反应制备过氧化氢。
考点: 化学实验 化学方程式 化学实验方案的设计 化学实验数据的分析和处理


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:计算题
将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
| 4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
| 实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质 量/g | 金属 状态 | c(H2SO4)/ (mol·L-1) | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉 末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉 末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
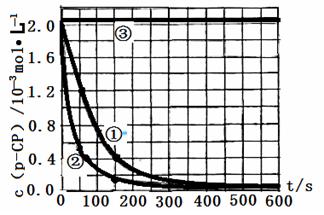
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图为制取乙酸乙酯的实验装置图。回答下列问题: 
(1)揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
(2)反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
(3)实验装置的比较:
利用如图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是__________________________。
(4)酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实(常温下)不能说明醋酸是弱电解质的是
| A.醋酸钠溶液pH>7 |
| B.醋酸溶液能溶解碳酸钙 |
| C.0.1mol·L-1醋酸溶液pH=2.9 |
| D.pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,正确的是
A.用惰性电极电解 溶液分别得到单质 溶液分别得到单质 和Cl2 和Cl2 |
B.常温下,某溶液中由水电离出的 ,该溶液一定呈酸性 ,该溶液一定呈酸性 |
C. 溶液和 溶液和 溶液加热蒸干、灼烧都得到 溶液加热蒸干、灼烧都得到 |
| D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com