
 命名:2,2,3,4-四甲基戊烷.
命名:2,2,3,4-四甲基戊烷.分析 (1)烷烃的通式为CnH2n+2,烷烃分子的同系物之间相差1个CH2时,相对分子质量增加14;
(2)甲烷在光照条件下与氯气发生取代反应生成一氯甲烷;
(3)① ,该有机物为烷烃,主链最长碳链含有5个C,编号从右到左,2号C有2个甲基,在3、4号C各含有1个甲基;
,该有机物为烷烃,主链最长碳链含有5个C,编号从右到左,2号C有2个甲基,在3、4号C各含有1个甲基;
②2,2-二甲基-3-乙基戊烷的结构简式为:CH3C(CH3)(CH3)CH(C2H5)CH2CH3.
解答 解:(1)烷烃的通式为CnH2n+2,烷烃分子的同系物之间相差1个CH2或多个CH2原子团,烷烃分子中的碳原子数目每增加一个,相差CH2,其相对分子质量增加14;故答案为:CnH2n+2;14;
(2)甲烷在光照条件下与氯气发生取代反应生成一氯甲烷,方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代反应;
(3)① ,该有机物为烷烃,主链最长碳链含有5个C,主链为戊烷,编号从右到左,2号C有2个甲基,在3、4号C各含有1个甲基,该有机物命名为:2,2,3,4-四甲基戊烷;
,该有机物为烷烃,主链最长碳链含有5个C,主链为戊烷,编号从右到左,2号C有2个甲基,在3、4号C各含有1个甲基,该有机物命名为:2,2,3,4-四甲基戊烷;
故答案为:2,2,3,4-四甲基戊烷;
②2,2-二甲基-3-乙基戊烷的结构简式为:CH3C(CH3)(CH3)CH(C2H5)CH2CH3,
故答案为:CH3C(CH3)(CH3)CH(C2H5)CH2CH3.
点评 本题主要考查了有机物结构简式的书写、命名及甲烷的取代反应,难度不大.要注意掌握有机物的结构特点是解题的关键.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
 甲烷分子中的四个氢原子都可以被取代.甲烷分子的四个氢原子都被乙烯基(CH2═CH-)取代得到的产物的结构如图所示.下列对所得分子的描述中不正确的是( )
甲烷分子中的四个氢原子都可以被取代.甲烷分子的四个氢原子都被乙烯基(CH2═CH-)取代得到的产物的结构如图所示.下列对所得分子的描述中不正确的是( )| A. | 分子式为:C9H12 | |
| B. | 1mol此分子在一定条件下最多能与4mol H2发生加成反应 | |
| C. | 所有碳原子都在同一平面上 | |
| D. | 此物质属于烯烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ⑤H2O和H2O2
⑤H2O和H2O2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C的原子结构示意图: | B. | 二氧化碳的电子式: | ||
| C. | H2O2的电子式: | D. | C3H8的结构式:CH3-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
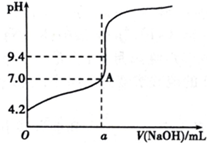 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:| 滴定次数 | 1 | 2 | 3 | 4 |
| V(标准溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、D不可能在同周期 | B. | C和D的单质可能化合为离子化合物 | ||
| C. | A、D可能在同一主族 | D. | D一定在第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com