
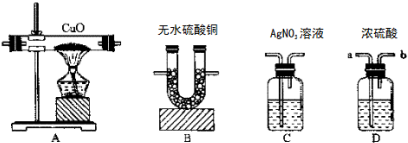
分析 用锌粒跟盐酸反应制取氢气(假设氢气中混有少量氯化氢气体和水蒸气),实验要求:①验证此氢气混有氯化氢和水蒸气,②除去氯化氢,③验证已除尽氯化氢,④用纯净的氢气还原氧化铜并进行称量以测定水的组成,先通过装置B检验水蒸气的生成,再通过装置C中硝酸银检验氯化氢气体的存在病除去氯化氢,通过装置C检验氯化氢是否除净,通过装置D中浓硫酸干燥气体氢气,通过装置A还原氧化铜生成铜和水蒸气,用装置B吸收生成的水蒸气,
(1)依据上述分析连接装置;
(2)洗气装置导气管赢长进短出;
(3)装置B是吸收水蒸气和检验水蒸气;
(4)装置C是检验氯化氢和吸收氯化氢;
(5)反应有氢气还原氧化铜,硫酸铜和水反应生成结晶水合物,氯化氢和硝酸银溶液反应生成氯化银沉淀;
解答 解:用锌粒跟盐酸反应制取氢气(假设氢气中混有少量氯化氢气体和水蒸气),实验要求:①验证此氢气混有氯化氢和水蒸气,②除去氯化氢,③验证已除尽氯化氢,④用纯净的氢气还原氧化铜并进行称量以测定水的组成,先通过装置B检验水蒸气的生成,再通过装置C中硝酸银检验氯化氢气体的存在病除去氯化氢,通过装置C检验氯化氢是否除净,通过装置D中浓硫酸干燥气体氢气,通过装置A还原氧化铜生成铜和水蒸气,用装置B吸收生成的水蒸气,
(1)依据上述分析连接装置的顺序为:B→C→C→D→A→B,
故答案为:B→C→C→D→A→B;
(2)洗气装置导气管赢长进短出,若选用装置D,则气体应由a进b出,故答案为:a;b;
(3)装置B的作用是吸收氢气还原氧化铜水蒸气和检验氢气中含有水蒸气,
故答案为:证明有水和吸收水;
(4)装置C是检验生成的氢气中含有氯化氢和吸收氯化氢、证明无HCl气体,防止干扰后续实验,
故答案为:证明有HCl气体和吸收HCl气体、证明无HCl气体;
(5)反应有氢气还原氧化铜,硫酸铜和水反应生成结晶水合物,氯化氢和硝酸银溶液反应生成氯化银沉淀;,反应的化学方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;5H2O+CuSO4═CuSO4•5 H2O或HCl+AgNO3═AgCl↓+HNO3
故答案为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;5H2O+CuSO4═CuSO4•5 H2O或HCl+AgNO3═AgCl↓+HNO3.
点评 本题考查了实验室制备氢气、气体除杂、气体检验、装置连接等,掌握基础是解题关键,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:选择题
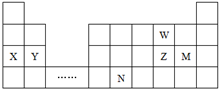
| A. | 离子半径:W2->Y2+ | |
| B. | 电解X与Z形成的化合物的水溶液,不能得到X单质 | |
| C. | 碘的氢化物酸性比M的氢化物酸性弱 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| H2 | HCl | Cl2 | ClF |
| 两个原子的s轨道重叠 | 氢原子的s轨道和氯原子的p轨道重叠 | 一个氯原子的s轨道和另一个氯原子的p轨道重叠 | 氯原子的p轨道和氟原子的p轨道重叠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 测得反应后溶液中Na+与Cl-的个数比为1:1 | |
| D. | 滴入几滴酚酞试液,酚酞试液不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为;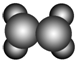 ③能与水在一定条件下反应生成C ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为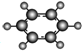 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为  |
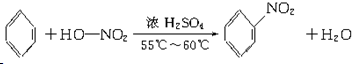 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
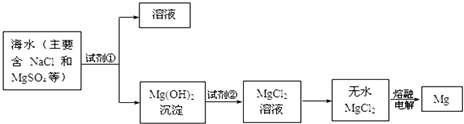
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,在空气中易变质,久置后变为过氧化钠 | |
| B. | 用湿润的蓝色石蕊试纸检验氨气 | |
| C. | 新制的氯水通常保存在棕色玻璃试剂瓶中,并现用现配 | |
| D. | 漂粉精的有效成分为氯化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
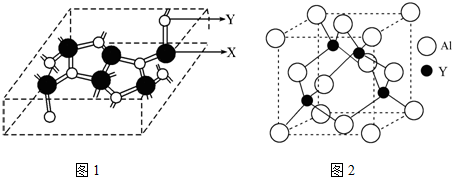
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com