
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示:
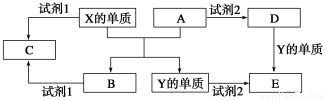
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
(1)Fe2O3+2Al 2Fe+Al2O3
2Fe+Al2O3
(2)2Al+2OH-+2H2O=2AlO2—+3H2↑
(3)①取少量D的溶液于试管中,滴加几滴KSCN溶液,溶液呈血红色,证明有Fe3+
②Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
【解析】A、B是氧化物,元素X、Y的单质是生活中常见的金属,结合图可知A是Fe2O3,X的单质是Al,B是Al2O3,Y的单质是Fe。若试剂1是NaOH溶液,则C为NaAlO2。若试剂1和试剂2均是稀硫酸,则D的溶液中含Fe3+,可用KSCN溶液检验,C的溶液中含Al3+,易水解,E为FeSO4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2+bCl2+cC aTiCl4+cCO反应(1)
aTiCl4+cCO反应(1)
TiCl4+2Mg Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:实验题
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
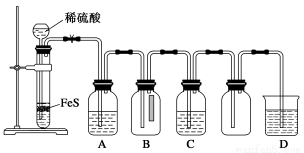
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
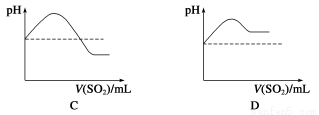
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:填空题
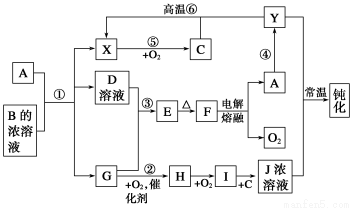
A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)。
请填写下列空白:
(1)B的电子式为____________________________;
(2)现用A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。其正极反应式为____________________;
(3)反应⑥的化学方程式为__________________________,反应④在冶金工业上属于________________(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为_____________________________;
(5)反应②的化学方程式为________________________________________________;
反应③的离子方程式为___________________________________________________。
查看答案和解析>>
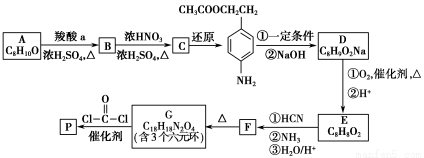
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:填空题
可降解聚合物P的合成路线如下:
已知:
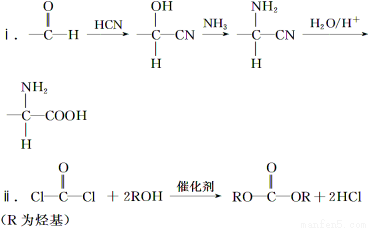
(1)A的含氧官能团名称是________。
(2)羧酸a的电离方程式是________。
(3)B→C的化学方程式是________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是________。
(5)E→F中反应①和②的反应类型分别是________。
(6)F的结构简式是________。
(7)聚合物P的结构简式是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )

A.①②④ B.②③④ C.①②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:填空题
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
B | D |
|
|
| E |
图①
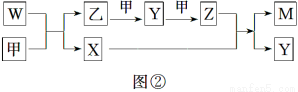
请回答下列问题:
(1)Z的化学式为__________________。
(2)E的单质与水反应的离子方程式为________________________________________。
(3)W?空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W?空气燃料电池放电时,正极反应式为________________________________,负极反应式为____________________。
(4)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
某小组按图1所示的装置探究铁的吸氧腐蚀。
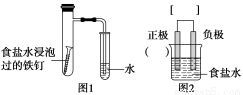
完成下列填空:
(1)图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。
(2)写出正、负极反应的方程式。
正极:________________,负极:________________。
(3)按图1装置实验,约8分钟才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是____________________(填字母序号)。
a.用纯氧气代替具支试管内的空气
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
(4)升高温度可以加快化学反应速率,建议用酒精灯加热具支试管。这一措施________(填“可行”或“不行”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s)??CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=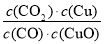
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com