
下列叙述正确的是 ( )。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
解析 KW=c(H+)·c(OH-),且KW只与温度有关,所以,在常温下,纯水、酸性、碱性或中性稀溶液中均有KW=1×10-14;在温度不确定时,中性溶液里的c(H+)不一定等于1×10-7 mol·L-1;0.2 mol·L-1 CH3COOH溶液中的CH3COOH电离程度比0.1 mol·L-1 CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol·L-1 CH3COOH溶液中的c(H+)小于0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍;当c(H+)或c(OH-)大于1 mol·L-1时,用pH表示溶液的酸碱性就不简便了,而是直接用c(H+)或c(OH-)来表示。
答案 A


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③
C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
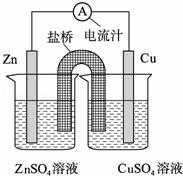
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
|
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
|
| C. | 用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
|
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10﹣14 | KW | 1×10﹣12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW 1×10﹣14(填“>”、“<”或“=”),判断的理由是
(2)25℃下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1:V2= .
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸
性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO﹣)(填“>”、“=”或“<”).
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、“中”
或“碱”),溶液中c(Na+) c(CH3COO﹣)[填“>”、“=”或“<”]
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH 7(填“大于”、“小于”或“等于”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是: (填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,取100 mL某酸溶液,测得其pH等于1,下列叙述正确的是 ( )。
A.该溶液中的c(H+)≥0.1 mol·L-1
B.把该溶液稀释成1 L后,pH≥2
C.把该溶液稀释成1 L后,pH<2
D.完全中和此溶液需0.1 mol·L-1 NaOH的体积≥100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同、浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同、浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同、pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同、pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或实验原理的说法中正确的是()
A. 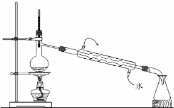 用如图装置进行蒸馏实验
用如图装置进行蒸馏实验
B.  用如图装置吸收氯化氢气体
用如图装置吸收氯化氢气体
C.  用酒精提取溴水中的溴
用酒精提取溴水中的溴
D. 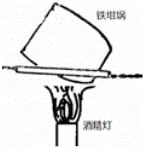 用如图装置灼烧小苏打制取少量的苏打
用如图装置灼烧小苏打制取少量的苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
乙二醇是目前市售汽车发动机防冻液的主要化学成分,能显著降低凝固点.
已知:(X代表卤素原子,R代表烃基)

利用上述信息,按以下步骤从乙烷合成乙二醇.(部分试剂和反应条件已略去)
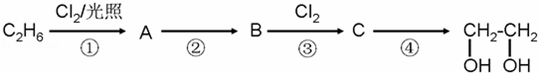
A分子中含有一个氯原子,B的产量是一个国家石油化工水平的重要标志.
请回答下列问题:
(1)分别写出B、C的结构简式:B 、C .
(2)反应①~④中属于取代反应的是 .(填数字代号)
(3)化合物D与C互为同分异构体,D的结构简式为 .
(4)试写出A→B和C→乙二醇反应的化学方程式 ; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com