
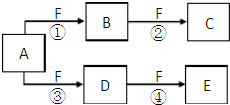
 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示. ,故答案为:
,故答案为: ;
;
| ||
| 3mol |
| 12mol |


科目:高中化学 来源: 题型:
| A、已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=2×(-57.3)kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
D、葡萄糖的燃烧热是2 800 kJ?mol-1,则
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
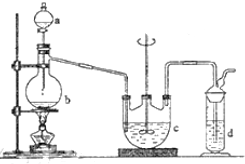 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
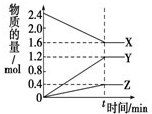
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
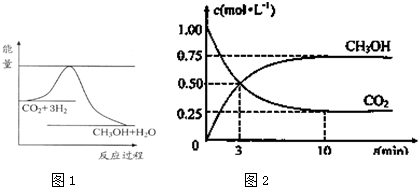
查看答案和解析>>
科目:高中化学 来源: 题型:
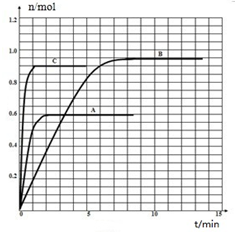
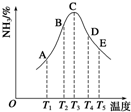 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
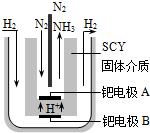 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3+CaCl2═CaCO3↓+2NaCl | ||||
| B、Fe+CuSO4═Cu+FeSO4 | ||||
C、2NaHCO3
| ||||
| D、Na2O2+SO2═Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com