
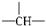 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
分析 该有机物中含有a个-CH3,n 个-CH2-,m个  ,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,根据烷烃通式计算出H原子个数,计算已知的H原子个数,剩余的就是OH原子个数,据此分析解答.
,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,根据烷烃通式计算出H原子个数,计算已知的H原子个数,剩余的就是OH原子个数,据此分析解答.
解答 解析:设OH数为x,①若烃基为烷基,则通式为:C a+m+nH 2(a+m+n)O x,由H守恒,2 n+m+3a+x=2a+2 m+2 n+2,解得x=m+2-a,D正确.②若烃基为环烷烃基,则通式为:C a+m+nH 2(a+m+n)O x,由H守恒,2 n+m+3a+x=2a+2 m+2 n,得x=m-a,A正确.故选AD.
点评 本题考查常见有机物结构,侧重考查学生知识迁移能力,采用补缺法分析解答即可,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和盐酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×0×10-amol/L和是1.0×10-bmol/L,在此温度时,水的离子积为1.0×10-(a+b) | |
| D. | 常温下,0.1mol/L酸HA pH=3,0.1mol/L 碱BOH pH=13,则盐BA溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
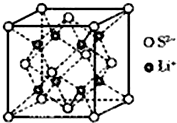 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: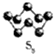 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.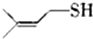 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
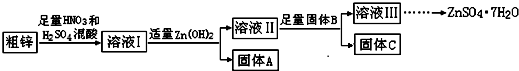
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A2B3是三氧化二铝 | B. | A3+与B2-最外层上的电子数相同 | ||
| C. | A是第2周期第ⅢA族的元素 | D. | B是第3周期第ⅥA族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Li3N | NaNH2 | SiBr4 | Mg2Si |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com