
分析 根据阿伏加德罗定律可知温度体积保持不变时,压强于物质的量成正比,C+O2=CO2,2C+O2=2CO,由上述方程式可看出只发生前者则压强与原来的相同,只发生后者则压强是原来的2倍;而现测得容器内压强比原来大0.4倍,说明上述两反应发生,即生成CO2和CO的混合物,由此分析解答;
解答 解:根据阿伏加德罗定律可知温度体积保持不变时,压强于物质的量成正比,C+O2=CO2,2C+O2=2CO,由上述方程式可看出只发生前者则压强与原来的相同,只发生后者则压强是原来的2倍;而现测得容器内压强比原来大0.4倍,说明上述两反应发生,即生成CO2和CO的混合物,8克氧气为0.25mol,反应后气体(CO2和CO)总物质的量为0.25×1.4=0.35mol,这两种气体都是每摩尔中含1mol碳原子,所以参加反应的炭为0.35mol,参与反应的碳的质量为4.2克,
答:参与反应的碳的质量为4.2克.
点评 本题主要考查学生对完全反应和不完全反应以及物质在反应中的质量关系的认识.解题时,学生需根据化学方程式认真分析物质在反应中的质量关系,才能正确解答.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
 +HNO3(浓)$→_{55℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
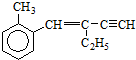 下列结论正确的是( )
下列结论正确的是( )| A. | 该有机物分子式为C13H16 | |
| B. | 该有机物分子最多有4个碳原子共直线 | |
| C. | 该有机物属于苯的同系物 | |
| D. | 该有机物分子最多有13个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
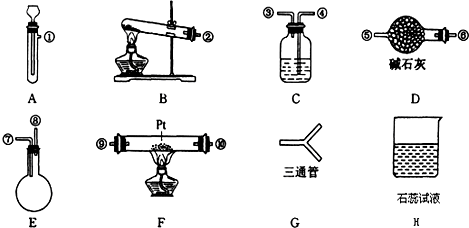
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
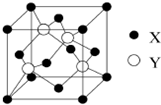 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,22.4L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0g CH4中含有共价键的数目为NA | |
| C. | 标准状态下,2.24L Cl2与足量NaOH溶液反应,转移电子数目为0.1NA | |
| D. | 常温下,1molNa2O2所含的阴阳离子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量5.22g食盐 | |
| B. | 用100mL的量筒取5.2mL稀盐酸 | |
| C. | 用100mL的容量瓶配置50mL 0.1mol/L盐酸 | |
| D. | 用25mL的酸式滴定管量取15.12mL高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
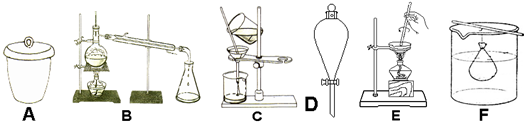
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两元素形成的最高价氧化物水化物的酸性A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的金属性比B的金属性强 | |
| D. | A的阴离子比B的阴离子还原性弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com