
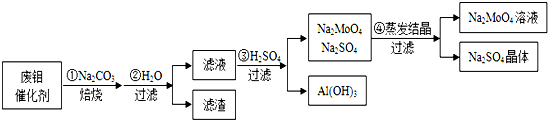
���� MoO3��Al2O3��Na2CO3�ķ�Ӧ��SiO2��Na2CO3�ķ�Ӧ���ƣ�����̼���Ʊ���ʱ������Na2MoO4��NaAlO2������ˮ�ܽ���ȥ���ʣ�����������ݣ������������������������˺���Һ�д��������ƺ�Na2MoO4�������ܽ�Ȳ�ͬ���������ᾧ�ɵõ�Na2SO4�����Na2MoO4��
��1������̼���Ʊ���ʱ������Na2MoO4��NaAlO2��MoO3��Na2CO3��Ӧ����Na2MoO4�Ͷ�����̼��
��2�����������£���������̼���Ʒ�Ӧ����Na2AlO2������ڢڲ��������������к��������������������ӽ�����������Һ��������������γ�Ѫ��ɫ��Һ���ʵ����飻
��3����Һ�м������������������������ܽ⣬һ�����òⶨ��ҺPH���ƣ�ת����ϵ������֪�������ᾧ�õ������ƾ����Na2MoO4��Һ��˵���������ܽ�����¶ȱ仯��
��4��MoO3������������Ӧ�������º�����Ӧ���������������
��5������ϡ���������ΪAl��OH��3����Һ�к���Na2SO4��Na2MoO4����֪��n��Na2CO3��=$\frac{5.30g}{106g/mol}$=0.05mol��n��Na2SO4��=$\frac{6.39g}{142g/mol}$=0.045mol����Na2MoO4����Na�غ��֪n��Na2MoO4��=0.005mol��m��Mo��=0.005mol��96g/mol=0.48g������õ������������Ԫ�ص�����������
��� �⣺��1��MoO3��Al2O3��Na2CO3�ķ�Ӧ��SiO2��Na2CO3�ķ�Ӧ���ƣ�����̼���Ʊ���ʱ������Na2MoO4��NaAlO2��MoO3��Na2CO3��Ӧ�Ļ�ѧ����ʽΪMoO3+Na2CO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2MoO4+CO2����
�ʴ�Ϊ��MoO3+Na2CO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2MoO4+CO2����
��2�����������£���������̼���Ʒ�Ӧ����Na2AlO2����Һ�к��б��պ�����Na2MoO4��Na2AlO2�Լ�������Na2CO3������ڢڲ��������������к�����������ȡ��������ϴ��Һ���Թ��еμӼ���KSCN��Һ������Һ��죬��֤������������
�ʴ�Ϊ��Na2AlO2��ȡ��������ϴ��Һ���Թ��еμӼ���KSCN��Һ������Һ��죬��֤������������
��3���ڢ۲�����H2SO4��Ҫ�������������������ܽ⣬ͨ����ͨ������Һ��pH������H2SO4��������ת����ϵ�Т������ᾧ��Һ�õ������ƾ����Na2MoO4��Һ����Na2SO4��ȣ�Na2MoO4���ܽ�����¶ȵ�Ӱ��仯��С���������ܽ�����¶�Ӱ������������壬
�ʴ�Ϊ������Һ��pH����С��
��4��MoO3������������Ӧ�������º�����Ӧ�����������������Ӧ�Ļ�ѧ����ʽΪ��4Al+2MoO3$\frac{\underline{\;����\;}}{\;}$2Mo+2Al2O3��
�ʴ�Ϊ��4Al+2MoO3$\frac{\underline{\;����\;}}{\;}$2Mo+2Al2O3��
��5������ϡ���������ΪAl��OH��3����Һ�к���Na2SO4��Na2MoO4��
��֪��n��Na2CO3��=$\frac{5.30g}{106g/mol}$=0.05mol��n��Na2SO4��=$\frac{6.39g}{142g/mol}$=0.045mol������Na�غ��֪n��Na2MoO4��=0.005mol��
m��Mo��=0.005mol��96g/mol=0.48g��
�أ�Mo��=$\frac{0.48g}{5g}$��100%=9.60%��
�ʴ�Ϊ��9.60%��
���� ���⿼�����ʵķ��롢�ᴿ��Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬ע�����ʵ���ԭ�������ʵ����ʣ�Ϊ������Ĺؼ����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
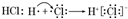
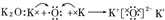
| A�� | �٢� | B�� | �� | C�� | �� | D�� | ������ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| Ԫ�� | �����Ϣ |
| A | �ڳ��¡���ѹ�£��䵥�������壬��������Ի�������ʶ��Ҫ�����ߣ�������Ϊ�������������ȼ�� |
| B | ��ҵ��ͨ������Һ̬��������䵥�ʣ���ij��ͬ���������DZ�������ر���������Ҫ���� |
| C | ֲ��������Ҫ��֮һ�������γɶ������������һ��������ҽ����ʹ�õ������� |
| D | �������䵥��Ϊ����ɫ��ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���� |
| E | ���ڵؿ��д����ḻ�������岻��ȱ�ٵ���Ԫ��֮һ���䵥��Ϊ����ɫ���壬�ǹ�ũҵ�����в��ɻ�ȱ�Ľ������ϣ������ڻ�е�Ʊ�����������ҵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �屽�л����壬����KI��Һ�� | |
| B�� | �����л�����ϩ��ͨ��������һ�������·�Ӧ��ʹ��ϩת��Ϊ���� | |
| C�� | �������л���ŨHNO3��ŨH2SO4�����䵹��NaOH��Һ�������ã���Һ | |
| D�� | ��ϩ�л���SO2��CO2������ͨ������KMnO4��Һ��ϴ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ���ѽ���Եõ�����ϩ | |
| B�� | ��֬ˮ��ɵõ���������� | |
| C�� | ���������͵������ж�����̼̼���� | |
| D�� | ���Ǻ���ѿ�ǵ���ɶ���C12H22O11��ˮ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
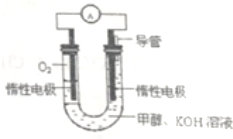 ��ѧ��Ԥ�ԣ�ȼ�ϵ�ؽ���21���ͻ�õ�������Ҫ;�����������ƻ����״�ȼ�ϵ�����ھ���Ŀ�ģ�һ�ּ״�ȼ�ϵ���Dz��ò���̼������Ϊ�缫��������KOH���Һ��ֱ�Ӽ��봿����ļ״���ͬʱ��һ���缫ͨ�������
��ѧ��Ԥ�ԣ�ȼ�ϵ�ؽ���21���ͻ�õ�������Ҫ;�����������ƻ����״�ȼ�ϵ�����ھ���Ŀ�ģ�һ�ּ״�ȼ�ϵ���Dz��ò���̼������Ϊ�缫��������KOH���Һ��ֱ�Ӽ��봿����ļ״���ͬʱ��һ���缫ͨ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | V ��Na2CO3��/mL | ������� | ��� | ��Ӧ�¶�/�� | ������� | |
| 1 | 2.8 | �ࡢ��ɫ | 1 | 40 | �ࡢ��ɫ | |
| 2 | 2.4 | �ࡢ��ɫ | 2 | 60 | �١�dz��ɫ | |
| 3 | 2.0 | �϶ࡢ��ɫ | 3 | 75 | �϶ࡢ��ɫ | |
| 4 | 1.6 | ���١���ɫ | 4 | 80 | �϶ࡢ��ɫ��������ɫ�� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�м�������ƣ�Na+H2O�TNa++OH-+H2�� | |
| B�� | ��NaOH��Һ����NH4Cl��Һ�е�笠����ӣ�NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O | |
| C�� | �Ȼ�������Һ��ͨ��������Fe2++Cl2�TFe3++2Cl- | |
| D�� | ��ʳ�׳�ȥˮƿ�е�ˮ����CO${\;}_{3}^{2-}$+2CH3COOH�T2CH3COO-+CO2��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com