
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:

(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是________________________________________________。
(2)反应一段时间后,B中的现象为___________________________。
(3)装置C的作用是________________;装置D的作用是___________,F的作用是___________________________________________。
(4)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________。(用含m和a的式子表示)
【答案】常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应 品红溶液红色褪去 除去二氧化硫 除去水蒸气 防止空气中的水蒸气和CO2进入E,减少实验误差 ![]() ×100%
×100%
【解析】
铁和碳单质均可以和浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫的检验可以用品红,吸收可以用高猛酸钾,将产生的二氧化碳用浓硫酸干燥,通入碱石灰,根据碱石灰增加的质量可以确定二氧化碳的质量,根据C元素守恒,可以计算碳单质的质量,进而计算碳的质量分数,据此解答。
(1) 往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(2)由于铁、碳与浓硫酸发生反应时均有二氧化硫生成,二氧化硫具有漂白性,在盛有品红溶液的B试管中,通入二氧化硫,溶液褪色;
故答案为:品红溶液红色褪去;
(3)该实验测定二氧化碳的质量,进而计算合金中碳的质量分数。因此装置C盛有高锰酸钾溶液,可以吸收二氧化硫气体,装置D中浓硫酸是吸收其他中的水蒸气,除去水蒸气;F中的碱石灰可防止空气中的水蒸气和CO2进入E。
故答案为:除去二氧化硫;除去水蒸气;防止空气中的水蒸气和CO2进入E,减少实验误差;
(4)U形管增加的质量即为二氧化碳的质量,根据碳元素守恒,合金中碳的质量为![]() ×12 g/mol=
×12 g/mol=![]() g,所以合金中碳的质量分数为
g,所以合金中碳的质量分数为![]() ×100%。
×100%。
故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案, 下列说法正确的是

A. 沉淀l为BaCO3和BaSO4
B. 沉淀2可能为AgCl和Ag2SO4
C. 该污水中一定存在Fe3+,不存在Fe2+
D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2 和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则计算:
(1)制Cl2的反应中转移电子的数目?
(2)生成Cl2的体积(标准状况下)?
(3)制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用图示装置完成相关实验合理的是
选项 | ①中物质 | ②中物质 | 实验目的 | 装置 |
A | 乙醇 | K2Cr2O7溶液 | 验证乙醇的还原性 |
|
B | 浓盐酸 | KMnO4固体 | 制取并收集氯气 | |
C | 少量氯化铝溶液 | 浓氢氧化钠溶液 | 制取氢氧化铝沉淀 | |
D | 稀硝酸 | 铜粉 | 制取并收集NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某加碘食盐中是否含有KIO3,取相同食盐样品进行下表所示实验:
(已知:KIO3 + 5KI + 3H2SO4![]() 3I2 + 3K2SO4 + 3H2O)
3I2 + 3K2SO4 + 3H2O)
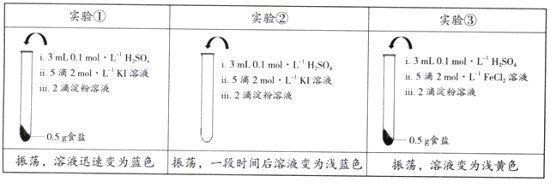
下列说法中正确的是
A. 仅由实验①就能证明食盐样品中存在KIO3
B. 实验②中发生反应的离子方程式为4I-+ O2 + 4H+ ![]() 2I2 + 2H2O
2I2 + 2H2O
C. 实验③能证明食盐样品中不存在KIO3
D. 以上实验说明离子的还原性:I- > Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com