
分析 (1)依据盖斯定律和热化学方程式计算得到所需的热化学方程式,利用热化学方程式的加减消去不需要的物质,注意加减时焓变随之变化;
(2)①平衡时各组分的浓度不随时间的变化而变化,由此分析各选项;
②根据v=$\frac{△c}{△t}$计算;
③根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
④根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
⑤要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
⑤恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变;
⑥恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变;
(3)①甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,总反应是燃料和氧气反应的化学方程式;
②根据电池的总反应确定酸碱性的变化;
③根据能量转化情况来回答;
④阳极发生氧化反应,电极反应式为:4OH--4e-=2H2O+O2↑或2H2O-4e-═O2↑+4H+,5min后在一个电极上有6.4gCu析出,转移电子的物质的量为0.2mol,所以生成气体的物质的量为:$\frac{0.2}{4}$=0.05mol,所以体积为:1.12L,电解质溶液浓度恢复遵循:“出什么加什么”的原则.
解答 解:(1)依据盖斯定律由题干所给的热化学方程式,结合盖斯定律计算(①+②)×6+③得到绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式,
6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g)△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol;
则△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol,即6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ•mol-1;
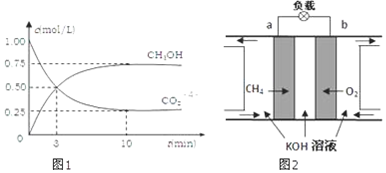
(2)①a.体系的压强不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
b.体系的密度一直不变,故错误;
c.各气体的浓度不再改变,说明正逆反应速率相等,反应达平衡状态,故正确;
d.各气体的质量分数不再改变,说明各物质的量不变,反应达平衡状态,故正确;
e.反应速率v(CO2)正:v(H2)逆=1:3,等效于v(CO2)正:v(CO2)逆=1:1,反应达平衡状态,故正确;
故选:b;
②利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案为:0.225;
③氢气的转化率=$\frac{2.25}{3}$×100%=75%,
故答案为:75%;
④平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
⑤要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,比值不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,增大反应物浓度,平衡向正反应方向移动,则比值增大,故D正确.
故答案为:CD;
⑥若是恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡正向移动,氢气的物质的量在增加后的基础上减小,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变达到平衡时H2的物质的量浓度与加氢气之前相比一定增大,故c1<c2,故答案为:<;
(3)①在碱性溶液中,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,故答案为:CH4-8e-+10OH-═CO32-+7H2O;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于;
④阳极发生氧化反应,电极反应式为:4OH--4e-=2H2O+O2↑或2H2O-4e-═O2↑+4H+,5min后在一个电极上有6.4gCu析出,转移电子的物质的量为0.2mol,所以生成气体的物质的量为:$\frac{0.2}{4}$=0.05mol,所以体积为:1.12L,电解质产生铜与氧气,所以加入氧化铜与碳酸铜,故选CD;
故答案为:4OH--4e-=2H2O+O2↑或2H2O-4e-═O2↑+4H+; 1.12;CD.
点评 本题考查较为综合,涉及热化学、电化学以及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 3(m-n) | B. | m+$\frac{n}{3}$ | C. | $\frac{n-m}{3}$ | D. | $\frac{4n-m}{12}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 乙烷(乙烯) | H2 | 催化剂加热 |
| ② | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①③ | C. | ③④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯可存储于钢瓶中运输和使用 | |
| B. | 氯水呈黄绿色,说明氯水中含有Cl2 | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 99℃时,Kw=l×l0-12 | |
| B. | pH减小的原因是HSO4-离子发生了水解 | |
| C. | 随温度的升高而增大 | |
| D. | 溶液中,水电离出的c(H+)=10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 | |
| B. | 氮氧燃料电池常用于肮天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇肮员使用 | |
| C. | 乙醇燃料电池的常用KOH溶液,该电池的负极反应为C2H5OH-12e-+3H2O═CO2↑+12H+ | |
| D. | 甲烷碱性燃料电池工作时OH-定向移动到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Na+、HCO3-、OH-、Ca2+ | D. | Cu2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将气体通过湿润的淀粉KI试纸,试纸变蓝,证明原气体是Cl2 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通过澄清石灰水,溶液变浑浊,证明原气体是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com