
【题目】某课题组对某样品W(组成用CxHyOzNaSb表示)进行探究。
实验一:确定W中元素组成
(1)取W样品,将有机氮转化成NH4+,_____________(补充实验方案),证明W中含氮元素。
(2)用燃烧法确定W样品中含碳、氢、硫三种元素,装置如图所示。
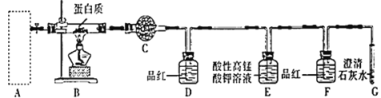
①A框内是加热固体制备氧气发生装置,写出A中反应的化学方程式:__________________。
②写出E中发生反应的离子方程式:_________________。
③从实验简约性考虑,D、E、F、G装置可以用下列装置替代:

能证明W含碳元素的实验现象是__________________。
实验二:测定W中硫元素含量
(3)取wgW样品在过量的氧气中充分燃烧,用V1mLc1mol·L-1碘水溶液吸收SO2,用V2mLc2mol·L-1Na2S2O3溶液滴定过量的I2。已知:2Na2S2O3+I2=2NaI+Na2S4O6。滴定终点的标志是__________________。该W样品中硫元素的质量分数为_________%。
(4)二氧化硫通入吸收液前必须通过过量的赤热铜粉(SO2不参与反应),否则会导致测定的硫元素质量分数_________(填“偏高”“偏低”或“无影响”)。
【答案】 加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,试纸变蓝色 2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑) 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ X中颜色变浅色,但不褪色;Y中变浑浊 滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复
K2MnO4+MnO2+O2↑) 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ X中颜色变浅色,但不褪色;Y中变浑浊 滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复 ![]() 偏低
偏低
【解析】实验一(确定W中元素组成):必须使用干燥氧气,A是发生装置,通过加热固体制备氧气,注意不能用双氧水制氧气。用无水硫酸铜检验H2O,D装置用于检验SO2,E装置用于除去SO2,F装置用于确定SO2是否除尽,因为SO2会干扰CO2的检验;
实验二(测定W中硫元素含量):根据SO2+I2+2H2O=2HI+H2SO4,2Na2S2O3+I2=2NaI+Na2S4O6。有:n(SO2)+![]() n(Na2S2O3)=n(I2),据此分析计算硫元素的质量分数;过量的氧气混在SO2气体中,会发生2SO2+O2+2H2O=2H2SO4,据此分析判断误差。
n(Na2S2O3)=n(I2),据此分析计算硫元素的质量分数;过量的氧气混在SO2气体中,会发生2SO2+O2+2H2O=2H2SO4,据此分析判断误差。
(1)检验铵离子,操作要点是加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,现象是由红色变蓝色,故答案为:加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,试纸变蓝色;
(2)①通过加热固体制备氧气,应该是加热高锰酸钾或氯酸钾分解制备氧气,反应的方程式为2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑),故答案为:2KClO3
K2MnO4+MnO2+O2↑),故答案为:2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑);
K2MnO4+MnO2+O2↑);
②用无水硫酸铜检验H2O,D装置用于检验SO2,E装置用于除去SO2,F装置用于确定SO2是否除尽,因为SO2会干扰CO2的检验。因此E中反应为2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4,离子方程式为2MnO4+5SO2+2H2O=2Mn2++5SO42+4H,故答案为:2MnO4+5SO2+2H2O=2Mn2++5SO42+4H;
③从简约装置看,X装置中试剂“过量”,它有三个作用:检验SO2、除去SO2、确认SO2除尽,实验现象是紫色溶液变浅——检验并除去SO2,不褪色——说明SO2已除尽了,最后Y中变浑浊,才能证明W中含碳元素,故答案为:X中颜色变浅色,但不褪色;Y中变浑浊;
(3)用硫代硫酸钠溶液滴定过量的I2,用淀粉溶液作指示剂。滴定前碘使淀粉溶液变蓝色,当碘完全消耗时蓝色变无色。根据SO2+I2+2H2O=2HI+H2SO4,2Na2S2O3+I2=2NaI+Na2S4O6。有:2n(SO2)+n(Na2S2O3)=2n(I2),ω(S)=![]() ×
××100%=
![]() %,故答案为:滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复;
%,故答案为:滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复;![]() ;
;
(4)氧化W时,O2过量,过量的氧气混在SO2气体中,用赤热铜粉除去O2。如果不除去氧气,在水溶液中会发生反应:2SO2+O2+2H2O=2H2SO4,结果测得V2偏大,测得S元素质量分数偏低,故答案为:偏低。


科目:高中化学 来源: 题型:
【题目】下列物质转化中,两种物质之间一步反应能实现的是
A. SiO2![]() 粗硅
粗硅![]() SiCl4
SiCl4![]() 高纯硅
高纯硅
B. NH3![]() NO
NO![]() NO2
NO2![]() 硝酸
硝酸
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
D. Fe3O4![]() Fe2 (SO4)3溶液
Fe2 (SO4)3溶液![]() FeSO4溶液
FeSO4溶液![]() FeSO4·7H2O
FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备能够成功的是
A. 电解饱和食盐水制备金属钠 B. MnO2和稀盐酸反应制备氯气
C. 铁和盐酸反应制备氯化铁 D. 石灰乳和氯气制备漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X 均为中学常见的单质或化合物,它们之间有如下转化关系(副产物已略去)。 试回答:
![]()
(1)若 X 是气体单质,则 A 可能是_____.
a.C b.Al c.Na d.Fe
(2)若 X 是金属单质,向 C 的水溶液中滴加 AgNO3 溶液,产生不溶于稀 HNO3 的白色沉淀;X 在 A
中可以燃烧。
①B 的化学式为_____;C 溶液在贮存时应加入少量 X,理由是(用必要的文字和离子方程式 表示)_________。
②向 C 的溶液中加入氢氧化钠溶液,现象是_________;写出涉及到的氧化还原反应的 化学方程式_____。
(3)若 A、B、C 为含有同种金属元素的化合物,X 为强酸或强碱溶液,则 B 的化学式为_____; 反应②的离子方程式为__________________或________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经催化加氢后可以生成 2甲基戊烷的是
A.CH2=CHCH(CH3)CH2CH3B.CH≡CCH(CH3)CH2CH3
C.CH3C(CH3)=CHCH2CH3D.CH3CH=C(CH3)CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 破坏化学键的过程,一定是化学变化过程
B. NaOH熔化时,既破坏了离子键又破坏了共价键
C. 反应H2+Cl2![]() 2HCl破坏了共价键,形成了共价键
2HCl破坏了共价键,形成了共价键
D. 17Cl和18Cl的相互转化属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com