
| A. | H2CO3?2H++CO32- | B. | CH3COOH═CH3COO-+H+ | ||
| C. | AgCl═Ag++Cl- | D. | NaHCO3═Na++H++CO32- |
分析 A.碳酸属于多元弱酸,存在分步电离,电离过程是可逆过程;
B.CH3COOH是弱电解质,存在电离平衡,用“?”连接;
C.氯化银属于强电解质,完全电离成银离子和氯离子;
D.HCO3-是H2CO3的酸式盐的酸根部分不能拆.
解答 解:A.碳酸属于弱酸存在分步电离,电离过程是可逆过程,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故A错误;
B.CH3COOH是弱电解质,部分电离,电离方程式为:CH3COOH?CH3COO-+H+,故B错误;
C.氯化银属于强电解质,溶于水的部分或熔融下完全电离,电离方程式为:AgCl═Ag++Cl-,故C正确;
D.NaHCO3是H2CO3的酸式盐,HCO3-部分电离,不能拆写,所以电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选C.
点评 本题考查电离方程式的书写,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解答的关键,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备1mol HRO3转移电子数一定为2NA | |
| B. | R、Z简单离子的还原性:Z(离子)<R(离子) | |
| C. | HZ分子的稳定性大于HR分子 | |
| D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
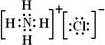 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
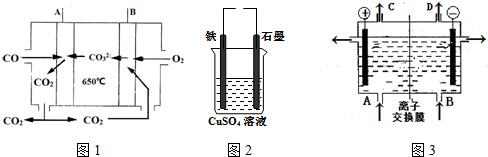
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com