

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol.L-1HCl,充分振荡,再加0.1mol.L-1BaCl2溶液 | 说明悬浊液中混有白色沉淀产生,有Cu4(0H)6S04. |
| 步骤2:另取少量悬浊液于试管中将试管放入装有沸水的小烧杯中,用水浴加热一段时间,取出试管观察 | 试管中黑色沉淀生成,说明悬浊液中混有Cu(0H)2. |
分析 铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)操作II、操作III的主要目的是除去杂质、富集铜元素;
(2)证明含有Cu4(OH)6SO4,可以证明硫酸根离子的存在设计实验验证;氢氧化铜的存在可以利用加热悬浊液氢氧化铜分解生成黑色的氧化铜沉淀.
解答 解:铜矿石溶于酸,然后采用过滤方法将难溶性固体和溶液分离,则操作I为过滤;然后向滤液中加入有机物采用萃取方法将含铜物质和溶液分离,所以操作II为萃取,得到的有机相中含有铜元素,再采用硫酸最萃取剂将含铜有机相萃取,得到硫酸铜溶液和有机相,将硫酸铜溶液加热浓缩、冷却结晶得到硫酸铜晶体,
(1)操作II、操作III的主要目的是除去杂质、富集铜元素,故答案为:除去杂质;
(2)利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液,由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.实验验证杂质的存在,可以检验是否含硫酸根离子检验Cu4(0H)6S04的存在,加入盐酸排除其他离子的干扰,加入氯化钡生成白色沉淀证明含Cu4(0H)6S04;
因氢氧化铜受热分解生成氧化铜黑色沉淀,则设计实验为取少量悬浊液于试管中利用沸水浴加热试管,试管中有黑色沉淀生成证明含Cu(OH)2;水浴加热的目的是避免温度过高氧化铜分解;
故答案为:
| 实验步骤 | 预期的现象和结论 |
| (1)加入过量2 mol.L-1HCl,充分振荡,再加0.1mol.L-1BaCl2溶液 | 有白色沉淀产生 |
| (2)将试管放入装有沸水的小烧杯中,用水浴加热一段时间,取出试管观察 | 试管中黑色沉淀生成 |
点评 本题考查物质制备,为高频考点,涉及物质成分检验、基本实验操作等知识点,明确反应原理是解本题关键,难点是(2)题实验方案设计,知道常见物质的性质及颜色,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
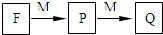 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.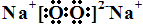 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
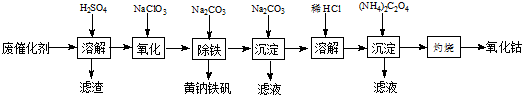

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
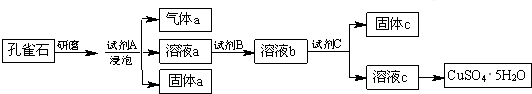
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 渗析 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应:O2+2H2O+4e-═4OH- | |
| B. | 当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) | |
| C. | 发生氧化反应的是负极 | |
| D. | 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com