
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 .氯化铁水溶液呈 性,原因是(用离子方程式表示): .
(2)物质的量浓度均为0.1mol/L的下列溶液pH 由大到小的顺序 (用序号表示)
①CH3COOH ②NH4Cl ③NaHCO3 ④Ba(OH)2 ⑤NaOH ⑥Na2CO3
(3)物质的量浓度相同的下列溶液按c(CO32﹣)由大到小的顺序是
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3.
考点:
盐类水解的应用.
专题:
盐类的水解专题.
分析:
(1)氯化铁为强酸弱碱盐,铁离子水解导致溶液呈酸性;
(2)先根据酸碱性判断溶液pH大小,再根据盐的水解情况确定、碱中氢氧根离子浓度大小确定溶液pH大小;
(3)碳酸是弱酸,部分电离;铵根离子促进碳酸根离子水解,碳酸氢根离子电离程度较小.
解答:
解:(1)氯化铁是弱酸强碱盐,铁离子易水解,为防止铁离子水解,配制氯化铁溶液时先将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度;
铁离子水解导致溶液呈酸性,水解离子方程式为Fe3++3H2O⇌Fe(OH)3+3H+,
故答案为:抑制Fe3+的水解;酸;Fe3++3H2O⇌Fe(OH)3+3H+;
(2)①CH3COOH是酸,溶液呈酸性;
②NH4Cl为强酸弱碱盐,溶液呈弱酸性;
③NaHCO3为强碱弱酸酸式盐,溶液呈弱碱性;
④Ba(OH)2为强碱,氢氧根离子浓度为0.2mol/L;
⑤NaOH为强碱,氢氧根离子浓度为0.1mol/L;
⑥Na2CO3为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,所以碱性大于碳酸氢钠,而小于NaOH;
所以这几种溶液pH大小顺序是④>⑤>⑥>③>②>①,故答案为:④>⑤>⑥>③>②>①;
(3)碳酸是弱酸,部分电离,碳酸根离子浓度最小;铵根离子促进碳酸根离子水解,碳酸氢根离子电离程度很小,所以这几种溶液中c(CO32﹣)由大到小的顺序是①>④>②>③,故答案为:①>④>②>③.
点评:
本题考查了盐类水解、弱电解质的电离,根据盐类水解特点、弱电解质电离特点来确定溶液中离子浓度大小,难点是(3)中碳酸根离子浓度大小比较,注意碳酸铵中铵根离子和碳酸根离子虽然相互促进水解,但水解程度较小.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
① ②
②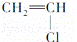 ③
③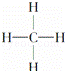 ④
④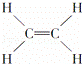 ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
|
| A. | 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
|
| B. | 投入钠能产生H2的是⑤⑦⑧⑨ |
|
| C. | 属于高分子材料的是⑧⑨⑩ |
|
| D. | 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明碳的非金属性强于硅的是
| A.2C+SiO2 | B.稳定性:CH4>SiH4 |
| C.CaCO3+SiO2 | D.金刚石不导电,晶体硅能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 0.1 mol•L﹣1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
|
| B. | 常温下,在由水电离出的c(OH﹣)=1×10﹣12mol•L﹣1的溶液中,Al3+可能大量存在 |
|
| C. | 常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
|
| D. | 常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
)下列溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H+) |
|
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X﹣)>c(OH﹣)=c(H+) |
|
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl﹣)>c(NH3•H2O)>c(OH﹣)>c(H+) |
|
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 需要加热方能发生的反应一定是吸热反应 |
|
| B. | 放热反应在常温条件下一定很容易发生 |
|
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 |
|
| D. | 灼热的炭与二氧化碳的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于氧化还原反应,又属于吸热反应的是( )
|
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 |
|
| C. | 甲烷在氧气中的燃烧反应 | D. | 灼热的碳与二氧化碳的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是(NA表示阿伏伽德罗常数)( )
①36g D2O含有的质子数为18NA
②16g O2和O3混合物中含氧原子数为NA
③6.4g Cu与过量浓硫酸反应,可得到2.24L SO2
④在标准状况下,22.4L CO2和SO2混合气体中含有原子数为3NA
⑤10L PH=12的NaClO溶液含Na+0.1NA
⑥在标准状况下,22.4L Cl2溶解于足量的水中,转移电子数为NA.
A. ①②⑥ B. ①③⑤ C. ①②④ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
探究新制饱和氯水成分的实验中,以下根据实验现象得出的结论错误的是( )
A. 将氯水滴加在蘸有红墨水的布条上,过一会儿红色布条会褪色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣
C. 向氯水中加入NaHCO3粉末,有气泡产生说明,氯水中含有H+
D. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色说明氯水中含有HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com