
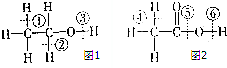 (1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.
(1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.分析 (1)乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答;
(2)根据反应原理可知:乙酸和钠反应生成氢气,O-H键断裂;乙酸和NaOH反应时,O-H键断裂;
(3)根据反应原理可知:乙酸和乙醇发生酯化反应生成酯,乙醇中的O-H键断裂;乙酸中的C-O键断裂.
解答 解:(1)乙醇和金属钠反应乙醇钠和氢气,键③断裂,在Cu催化下与O2反应时,生成乙醛,①、②键断裂,故答案为:③;①②;
(2)乙酸和钠反应时,O-H键断裂,即⑥断裂;乙酸和NaOH反应时,O-H键断裂,即⑤断裂;故答案为:⑥;⑤;
(3)乙酸和乙醇发生酯化反应时,乙醇中的O-H键断裂,即③断裂;乙酸中的C-O键断裂,即⑤断裂;故答案为:③;⑤.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的结构特点,尤其是共价键的断裂方式,答题时注意体会.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .已知反应④为取代反应,写出该反应的化学方程式CH3OH+
.已知反应④为取代反应,写出该反应的化学方程式CH3OH+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +HCl.
+HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
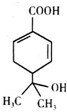
| A. | 分子式为C10H13O3 | |
| B. | 含有两种官能团,可使溴水和酸性高锰酸钾溶液褪色 | |
| C. | 能发生加成、取代、氧化等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH>7 | |
| C. | 物质的量浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| D. | 能使石蕊试液变红的溶液中,Fe2+、Na+、NO3-、Cl-能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com