
分析 (1)根据溶液稀释前后溶质物质的量不变计算所需浓盐酸的体积;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)氧化还原反应中所含元素化合价升高的反应物为还原剂;依据4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,生成1mol氯气,消耗氯化氢物质的量4mol,二氧化锰1mol计算解答.
解答 解:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,则xmL×10mol/L=100mL×2mol/L,解得:x=20.0,
所以应量取的浓盐酸体积是25.0mL,
故答案为:20.0;
(2)操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、100mL容量瓶,还缺少的仪器:胶头滴管;100mL容量瓶;
故答案为:胶头滴管;100mL容量瓶;
(3)4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,反应中,氯化氢中-1价的氯化合价升高,所以氯化氢为还原剂;
若产生标准状况下的Cl22.24L,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,依据4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,可知消耗氯化氢的物质的量为0.4mol,需要2mol•L-1的稀盐酸体积$\frac{0.4mol}{2mol/L}$=0.2L,即200mL;消耗二氧化锰物质的量为0.1mol,质量为87g/mol×0.1mol=8.7g;
故答案为:HCl;200;8.7.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
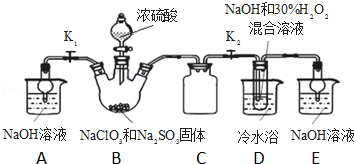
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
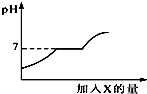 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
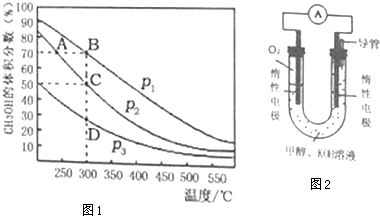
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO的质量是30g | |
| B. | 标准状况下,1 mol H2O的体积是22.4 L | |
| C. | 17 g NH3含有的氢原子总数为6.02×1023 | |
| D. | 0.1 mol Na2CO3中,Na+的物质的量为 0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com