
把足量氯气通入下列各物质的溶液中,阴离子和阳离子都能被氧化的是( )
A.NaOH B.Na2SO3
C.FeBr2 D.FeSO4
科目:高中化学 来源: 题型:
下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)在仪器上具体标明使用温度的是(不考虑温度计)______(填写编号,下同);可作反应容器并可加热的是______(填写编号)。
(2)需要用到温度计的实验是________。
①用乙醇170 ℃脱水制乙烯 ②石油分馏
③浓硫酸稀释 ④测定硝酸钾的溶解度
(3)玻璃棒的作用主要有以下三种:①搅拌 ②引流 ③蘸取溶液。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是________。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO 等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________。
等杂质离子以获得纯净的食盐”的实验中玻璃棒的作用可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C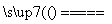 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2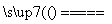 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C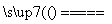 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde C.cde D.ab
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。

请回答下列问题:
(1)B的化学式是________,目前B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是______________________________________________。
(3)A和a溶液反应的离子方程式是___________________________________________。
(4)C和过量的盐酸反应的离子方程式是_____________________________________。
审题分析 本题应抓住框图中的转化关系,以题设条件C+过量盐酸—→E(白色沉淀)为突破口进行推断,并结合已有知识进行设定与推测。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-、I-),向甲中加入淀粉溶液和氯水,则溶
液变为橙色,再加入丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究,下列叙述错误的是( )
| 操作 | 现象 |
| ①取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| ②过滤,测漂粉精溶液的pH | pH试纸先变蓝,最后褪色 |
| ③
| 液面上方出现白雾;稍后,出现浑浊,溶液变为黄绿色;最终,产生大量白色沉淀,黄绿色褪去 |
A.Cl2和Ca(OH)2制取漂粉精的化学方程式是:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
B.pH试纸颜色的变化说明漂粉精溶液只具有漂白性
C.液面上方出现白雾,白雾中一定只含HCl
D.最后,产生大量白色沉淀,黄绿色褪去,推测白色沉淀主要是CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
反应Fe(s)+CO2(g)FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=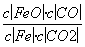
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com