

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |


科目:高中化学 来源: 题型:
| A、0.32mol、0.5mol、0.12mol |
| B、0.02mol、0.64mol、0.24mol |
| C、0.64mol、0.02mol、0.24mol |
| D、0.16mol、0.5mol、0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H3和H2互为氢元素的两种核素 |
| B、H3是氢元素的一种同位素 |
| C、相同体积的H3和H2气体所含分子数比为1:1 |
| D、H3的摩尔质量是3 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
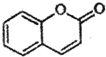 ) 是一种存在于某些植物的果、花等中的天然香料.又知:
) 是一种存在于某些植物的果、花等中的天然香料.又知: ;
;

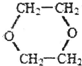 (是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
(是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、104g | B、90g |
| C、92g | D、88g |
查看答案和解析>>
科目:高中化学 来源: 题型:

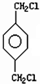 →A:
→A:查看答案和解析>>
科目:高中化学 来源: 题型:
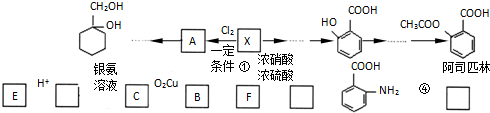
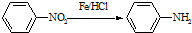 (苯胺,易被氧化)
(苯胺,易被氧化) 的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

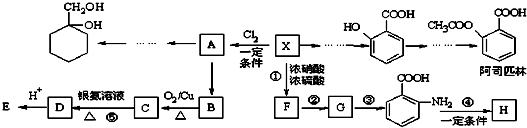
| A、A→B属于加成反应 | |||
| B、B、D均能与金属钠反应 | |||
| C、物质C的结构简式为CH3CHO | |||
D、生成E的化学方程式为:CH3CH2OH+CH3COOH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com