
| A. | Na+K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl- NO3- | D. | Al3+ K+ SO42-OH- |
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
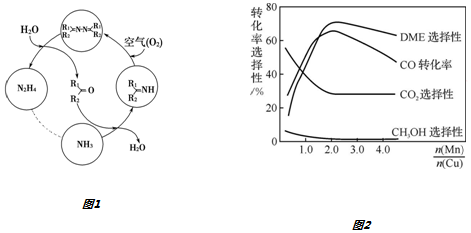
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 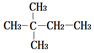 | B. | 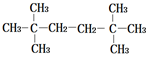 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL | |
| C. | 用10mL量筒量取8.25mL盐酸 | |
| D. | 用普通pH试纸测得某溶液pH为3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
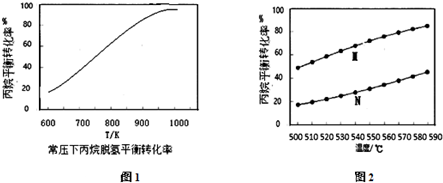
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com