
| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: | |
| D. | 四氯化碳的电子式 |
分析 A.CH3Cl为一氯甲烷的结构简式,不是结构式;
B.丁烷为含有4个C原子、无支链的饱和烃;
C.氯化氢为共价化合物,氯化氢中不存在阴阳离子,电子式中不能标出电荷;
D.漏掉了氯原子的最外层的3对未成键电子对.
解答 解:A.结构式中应该用短线代替所有的共用电子对,一氯甲烷的结构式为: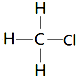 ,故A错误;
,故A错误;
B.丁烷的结构简式为CH3(CH2)2CH3,故B正确;
C.氯化氢属于共价化合物,分子中不存在阴阳离子,用电子式表示氯化氢的形成过程为: ,故C错误;
,故C错误;
D.四氯化碳为共价化合物,分子中存在4个碳氯共用电子对,碳原子和氯原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为: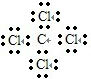 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、结构简式、结构式等知识,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,试题培养了学生的分析能力及规范答题能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 用没食子酸制造墨水主要利用了( )类化合物的性质.
用没食子酸制造墨水主要利用了( )类化合物的性质.| A. | 醇 | B. | 酚 | C. | 油脂 | D. | 羧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y均为金属元素,则X的金属性强于Y | |
| B. | 若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强 | |
| C. | 若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 | |
| D. | 若X、Y均为非金属元素,则最高价氧化物所对应的水化物的酸性Y强于X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯 | B. | 丙烯和丙烷 | ||
| C. | 甲烷和己烷 | D. | 乙炔和乙烯基乙炔( CH2=CH-C≡CH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3价电子总数均是8 | |
| B. | 次氯酸分子的结构式为:H-Cl-O | |
| C. | HS-和HCl均是含一个极性键的18电子粒子 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中加入少量BaCl2溶液. (或取试管B中溶液做焰色反应实验). | 不产生白色沉淀(或焰色不呈黄色) | 产品中不含 Na2SO4 |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com