
| A.有些物质是由原子直接构成,如金刚石、水晶等;有些物质是由分子直接构成,如干冰、氯化铵等;有些物质是由离子直接构成的,如食盐、烧碱等 |
| B.BF3、H2O、SiCl4、PCl5四种分子中所有原子都满足最外层为8电子结构 |
| C.非金属氧化物不都是酸性氧化物;碱性氧化物都是金属氧化物 |
| D.硫单质的熔点比钠单质的熔点高,这是由于前者比后者有更大的范德华力所致 |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)氨催化氧化的化学方程式为 :
(1)氨催化氧化的化学方程式为 : (2)原料气中空气必须过量,其主要原因是 ;
(2)原料气中空气必须过量,其主要原因是 ; (3)将铂铑合金做成薄丝网的主要原因是 ;
(3)将铂铑合金做成薄丝网的主要原因是 ; (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,为了提高水对二氧化氮的吸收率,可采取的措施为 (答2项)
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,为了提高水对二氧化氮的吸收率,可采取的措施为 (答2项)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 |
| B.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 |
| C.9gD216O所含的质子数为4.5NA(NA表示阿伏加德罗常数) |
| D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
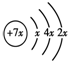 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com