
分析 (1)二氧化氮和水反应产物是硝酸和一氧化氮,据此书写离子方程式,根据化合价升降和电子转移进行相关计算;
(2)A.尾气中氮氧化物可以和氢氧化钠溶液反应转化为无毒的亚硝酸钠;
B.石灰乳Ca(OH)2和酸性气体二氧化硫之间可以发生反应生成亚硫酸钙和水;
C.汽车尾气中的有毒气体经催化剂作用可以转化为无毒物质二氧化碳和氮气;
D.氨气与一氧化氮在一定条件下反应,产物是氮气和水.
(3)①从硫酸铜溶液获得硫酸铜晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,据此回答;
②根据硝酸和金属铜反应的实质结合产生气体的量计算硝酸的物质的量,据公式c=$\frac{n}{V}$计算浓度;
③根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,据硝酸根的物质的量计算总共氢离子物质的量,进而计算硫酸的物质的量,得到结果即可.
解答 解:(1)二氧化氮和水反应产物是硝酸和一氧化氮,离子方程式为:3NO2+H2O=2H++2NO3-+NO,反应有2NA个电子转移,则参加反应的二氧化氮的物质的量为3mol,所以该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为1.5a mol,故答案为:3NO2+H2O=2H++2NO3-+NO;1.5a;
(2)A.尾气中氮氧化物可以和氢氧化钠溶液反应,方程式为:NO+NO2+2NaOH=2NaNO2+H2O,故A正确;
B.石灰乳Ca(OH)2和酸性气体二氧化硫之间可以发生反应生成亚硫酸钙和水,即SO2+Ca(OH)2═CaSO3+H2O,故B正确;
C.汽车尾气中的有毒气体CO、NO经催化剂作用可以转化为无毒物质二氧化碳和氮气,不会产生NO2、C,故C错误;
D.氨气与一氧化氮在一定条件下反应,产物是氮气和水,即4NH3+6NO$\frac{\underline{\;催化剂\;}}{△}$5N2+6H2O,故D正确.
故选C.
(3)①从硫酸铜溶液获得硫酸铜晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶或降温结晶;
②反应后生成标准状况下NO1.344L,物质的量是$\frac{1.344L}{22.4L/mol}$=0.06mol,所以做氧化剂的硝酸的物质的量是0.06mol,根据反应实质,NO3-~NO↑这些硝酸根离子来自硝酸,所以硝酸的物质的量是0.06mol,该混合酸中,硝酸的物质的量浓度c(HNO3)应为$\frac{0.06mol}{0.1L}$=0.6mol/L,故答案为:0.6mol/L;
③根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,该混合酸中,硝酸根的物质的量是0.06mol,所以氢离子物质的量是0.24mol,其中0.06mol来自硝酸,剩余的0.18mol来自硫酸,所以硫酸的物质的量是0.09mol,即硝酸与硫酸的物质的量之比为0.06:0.09=2:3,故答案为:2:3.
点评 本题涉及氧化还原反应中电子守恒的计算以及金属铜和硝酸反应的计算知识,属于综合知识的考查题,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.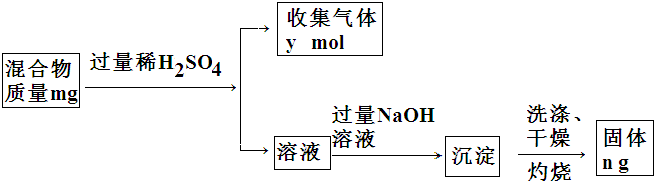
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是产生能量最高的营养物质 | |
| B. | 苯能发生氧化反应 | |
| C. | 纤维素可在人体内最终水解成葡萄糖 | |
| D. | 谷氨酸分子中含有2种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com