
A、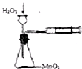 定量测定化学反应速率 |
B、 验证钠与水反映的热效应 |
C、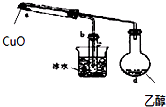 加热d即可进行乙醇的催化氧化实验 |
D、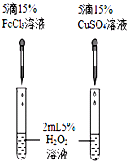 比较Fe3+和Cu2+对H2O2分解的催化效果 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
 由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生2.24L(标准状况)的气体.问:
由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生2.24L(标准状况)的气体.问:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食盐、水和乙烯为原料可以合成聚氯乙烯 |
| B、用氯气和乙炔为原料可以直接合成聚氯乙烯 |
| C、合成聚氯乙烯一定涉及氧化还原反应 |
| D、合成聚氯乙烯一定涉及加成聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴加在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氧化铁粉末溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O |
| C、硫酸滴加到氢氧化钡溶液中:H++OH-=H2O |
| D、碳酸氢钠和盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
| B、H2(g)+Cl2(g)═2HCl(g);△H=-183 kJ?mol-1 | ||||
C、HCl(g)═
| ||||
| D、H2(g)+Cl2(g)═2HCl(g);△H=+248 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 正反应速率 | 逆反应速率 |
| A.v(A)=2 mol?L-1?s-1 | v(A)=3 mol?L-1?s-1 |
| B.v(A)=2 mol?L-1?s-1 | v(B)=1.5 mol?L-1?s-1 |
| C.v(A)=2 mol?L-1?s-1 | v(B)=2 mol?L-1?s-1 |
| D.v(A)=1 mol?L-1?s-1 | v(C)=1.5 mol?L-1?s-1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2种 | B、4种 | C、6种 | D、8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | ||||
| B、向氯化铁溶液中加入铜:2Fe3++3Cu=2Fe+3Cu2+ | ||||
| C、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]--+4NH4+ | ||||
D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 按照题目的要求,回答下列有关题:
按照题目的要求,回答下列有关题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com