
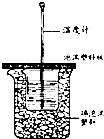
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
| 3.4℃+3.3℃+3.5℃ |
| 3 |
| Q |
| N |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | T | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600(mol/L)-2 |
| C、改变温度可以改变此反应的平衡常数 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度(mol?L-1) | 温度(℃) | 铁的状态 |
| A | 1.0 | 20 | 块状 |
| B | 1.0 | 20 | 粉末状 |
| C | 3.0 | 30 | 块状 |
| D | 3.0 | 30 | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题:
实验室里需用480mL 0.1mol?L-1的硫酸铜溶液.试回答该溶液配制过程中的下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
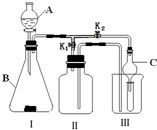 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| A、先加BaCl2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| B、先加BaCl2溶液有白色沉淀,再加稀硝酸沉淀不消失 |
| C、先加Ba(NO3)2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| D、先加稀盐酸无明显现象,再加BaCl2溶液有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当V=0时,[OH-]=[H+]+[HCO3-]+2[H2CO3] |
| B、当V=5时,[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] |
| C、当V=10时,[Cl-]=[CO32-]+[HCO3-]+[H2CO3] |
| D、当V=15时,[Na+]=[Cl-]>[HCO3-]>[OH-]>[H+] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com