
【题目】在25 ℃时,用蒸馏水稀释1 mol·L-1的醋酸溶液至0.01 mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A.  B.
B. 
C.  D.
D. 
【答案】A
【解析】醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(CH3COO-)、c(H+)都减小,温度不变水的离子积常数不变,所以c(OH-)增大。
A.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,因为溶液体积相同,所以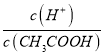 增大,故A正确;B.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,溶液体积相等,所以
增大,故A正确;B.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,溶液体积相等,所以 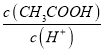 减小,故B错误;C.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小,n(CH3COO-)增大,溶液体积相等,所以
减小,故B错误;C.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小,n(CH3COO-)增大,溶液体积相等,所以 减小,故C错误;D.
减小,故C错误;D. 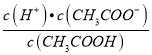 =Ka,温度不变,电离平衡常数不变,所以
=Ka,温度不变,电离平衡常数不变,所以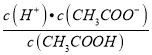 不变,故D错误;故选A。
不变,故D错误;故选A。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向氨水中滴入盐酸:OH﹣+H+=H2O
B.石灰乳与Na2CO3溶液反应:Ca2++CO32﹣=CaCO3↓
C.向澄清石灰水中通入少量二氧化碳:Ca2++2OH﹣+CO2=CaCO3↓+H2O
D.向沸水中逐滴滴加FeCl3饱和溶液:Fe3++3H2O ![]() Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答: 
(1)丁是;通常其用途为 .
(2)甲和丙的化学反应方程式为; 反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 , 物质的量之比为 , 原子总数之比为 , 质量之比为 .
(2)在标准状况下,①4g H2、②11.2L O2、③1mol H2O中,所含分子数最多的是 , 含原子数最多的是 , 质量最大的是 .
(3)标准状况下,1.7gNH3的体积为L,它与标准状况下L H2S含有相同数目的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )

A. 图中温度T1>T2
B. 曲线a、b均代表纯水的电离情况
C. 图中五点Kw间的关系:B>C>A=D=E
D. 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等做沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 碳酸盐 B. 硫酸盐 C. 硫化物 D. 以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com