
【题目】A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当 A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当 A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移____________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)____________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______________,检查其中刺激性气体产物X的方法是_______________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为__________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,生成气体X的离子方程式为 ,检验该气体的方法是 。
【答案】(1)①MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
②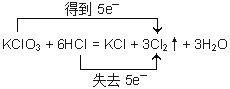
③4HSO3—+Cl2=SO42—+2Cl—+3SO2↑+2H2O
(2)①C、Cu;②将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2
(3)①0.3mol/L(1分);②![]() a或
a或![]() a(4)NaAlO2 NaCl
a(4)NaAlO2 NaCl
(5)铵,NH4++OH﹣![]() NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气。
NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气。
【解析】
试题分析:(1)如果Y是黄绿色气体,则Y是氯气。①当 A、B的物质的量之比为1∶4且A为黑色固体,则该反应为二氧化锰与浓盐酸混合加热制备氯气,反应离子方程式为MnO2 + 4H+ + 2Cl—![]() Mn2+ + Cl2↑ + 2H2O ;②当 A、B的物质的量之比为1∶6,则该反应为氯酸钾与浓盐酸反应生成氯气、氯化钾的水,化学方程式为KClO3+6HCl=KCl+3H2O+3Cl2↑。反应中氧化剂是氯酸钾,还原剂是氯化氢,根据电子得失守恒可知氧化剂与还原剂的物质的量之比是1:5,即反应中转移5个电子,所以用双线桥表示反应过程中的电子转移见答案;③氯气具有强氧化性,而亚硫酸氢钠具有还原性,二者发生氧化还原反应生成酸、钠盐与水。反应中产生的酸能与亚硫酸氢钠反应产生二氧化硫,SO2是大气污染物,因此一般不用亚硫酸氢钠,而用氢氧化钠,反应的离子方程式为4HSO3— + Cl2==SO42— + 2Cl— + 3SO2↑ + 2H2O 。
Mn2+ + Cl2↑ + 2H2O ;②当 A、B的物质的量之比为1∶6,则该反应为氯酸钾与浓盐酸反应生成氯气、氯化钾的水,化学方程式为KClO3+6HCl=KCl+3H2O+3Cl2↑。反应中氧化剂是氯酸钾,还原剂是氯化氢,根据电子得失守恒可知氧化剂与还原剂的物质的量之比是1:5,即反应中转移5个电子,所以用双线桥表示反应过程中的电子转移见答案;③氯气具有强氧化性,而亚硫酸氢钠具有还原性,二者发生氧化还原反应生成酸、钠盐与水。反应中产生的酸能与亚硫酸氢钠反应产生二氧化硫,SO2是大气污染物,因此一般不用亚硫酸氢钠,而用氢氧化钠,反应的离子方程式为4HSO3— + Cl2==SO42— + 2Cl— + 3SO2↑ + 2H2O 。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,该反应为碳与浓硫酸反应生成CO2、二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水,则A为C和Cu,刺激性气体产物X为二氧化硫,SO2具有漂白性,能使品红溶液褪色,因此检验二氧化硫的方法为将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,则A是铁,而不是铝,该反应为Fe与稀硝酸反应生成硝酸铁、NO与水。①100mL2mol/L的硝酸溶液中硝酸的物质的量为0.1L×2mol/L=0.2mol,过量的铁与稀硝酸发生反应3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,生成硝酸亚铁的物质的量为:0.2mol×3/8=0.075mol,其中硝酸根离子的物质的量是0.075mol×2=0.15mol,稀释至500mL后溶液中阴离子的物质的量浓度为0.15mol÷0.5L=0.3mol/L;②铁离子能氧化单质铁生成亚铁离子,设被还原的硝酸铁的物质的量是xmol,则根据反应的方程式2Fe3++Fe===3Fe2+可知反应后溶液中Fe3+的物质的量为(a-x)mol,Fe2+的物质的量为1.5xmol,则(a-x):1.5x=1:2,解得x=4a/7;或(a-x):1.5x=2:1,解得x=a/4。
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,白色沉淀是氯化银,则A中含有Cl-;B的焰色反应为黄色,应该含有Na元素。如果A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠;如果A与B按物质的量之比1:4反应则恰好生成偏铝酸钠、氯化钠和水,反应的化学方程式为AlCl3+4NaOH===NaAlO2+3NaCl+H2O,因此反应后溶液中溶质的化学式为NaAlO2、NaCl;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,X应该是氨气,则A是铵盐,B为强碱。检验该气体的方法是将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中,符合操作规范的是
A.向试管中滴加试剂时,将滴管下端紧靠试管内壁
B.用托盘天平称量药品时,右盘放药品,左盘放砝码
C.用pH试纸检验溶液的酸碱性时,将试纸浸入溶液中
D.萃取操作中倒转分液漏斗用力振荡时,应关闭玻璃塞和活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 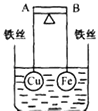
A.杠杆为导体和绝缘体时,均为A 端高B 端低
B.杠杆为导体和绝缘体时,均为A 端低B 端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳原子数为2的烃所具有的共同性质是( )
A.都难溶于水,且密度比水小
B.都能使溴水褪色
C.分子中各原子都处在同一平面内
D.都能通过加聚反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的物质,一定互为同系物的是
A.C2H4 和C4H8B.CH4和C3H8C.C2H6O和C3H8OD.C2H4Br2和C3H6Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生反应:M(g)+2N(g)![]() xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )
xP(g) ΔH<0,N、P的物质的量随时间变化的关系如图所示。下列有关说法不正确的是( )

A. x=2
B. 反应开始2 min内,v(P)=0.1 mol·L-1·min-1
C. 2 min后,降低温度平衡向右移动
D. 当容器内混合气体压强不再改变时,反应体系达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+ 2CO(g)![]() 2CO2(g) + S(l) △H<0
2CO2(g) + S(l) △H<0
完成下列问题:
(1)该反应的平衡常数表达式是 ___________;2L容器中,10分钟内,气体密度减小了8g/L,则CO的反应速率是____________。
(2)如果要提高上述反应的反应速率,可以采取的措施是________。(选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
(3)若反应在恒容的密闭容器中进行,下列有关说法正确的是________。(选填编号)
A.平衡前,随着反应的进行,容器内压强始终不变
B.当容器内温度不再变化时,反应达到了平衡
C.平衡时,其他条件不变,升高温度可增大平衡常数
D.其他条件不变,使用不同催化剂,该反应热效应不同
Ⅱ.硫酸工业尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-) 之比为___________。
该溶液中c(OH—) = c(H+)+ ______+ ________(用溶液中所含微粒的浓度表示)。
(5)用酸性重铬酸钾(K2Cr2O7)溶液也能吸收SO2,重铬酸钾被还原为Cr3+,写出该反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 制备溴苯时可以用苯和溴水反应
B. 乙醇既可以做燃料也可以在日常生活中使用,如无水乙醇常用于消毒
C. 等质量的乙烯和聚乙烯完全燃烧耗氧量相同
D. 分子组成上相差若干个CH2的有机物必定互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com