
【题目】下列反应中![]() H>0,
H>0,![]() S>0的是
S>0的是
A. 2Mg(s) + CO2(g)→ 2MgO(s) + C(s)
B. 低温下能自发进行的反应:NH3(g)+HCl(g) →NH4Cl(s)
C. 高温下能自发进行的反应:SiO2(s) +2C(s) →Si(s)+2CO(g)
D. 任何温度下均能自发进行的反应:2H2O2(l) → 2H2O(l) + O2(g)
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素为周期表前20号元素且原子序数依次增大,其中只有A、D为非金属元素。A的气态氢化物溶于水得到的溶液能使酚酞溶液变红。B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍。B、E元素同主族。
(1)E在元素周期表中的位置:____________,写出E的最高价氧化物对应水化物与C的单质反应的化学方程式:___________________________________。
(2)A的气态氢化物溶于水后的电离方程式为________________________________。
(3)B单质在空气中燃烧后的产物的电子式为____________,产物中存在的化学键类型有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________
(2)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为________。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)某课外活动小组同学用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与b连接,则B极的电极反应式为 。
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需最少条件是 ( )
①X中含碳质量分数 ②X中含氢质量分数③X在标准状况下的体积 ④X对H2的相对密度⑤X的质量
A.①②B.①②④
C.①②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
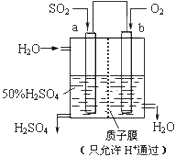
①上述生产硫酸的总反应方程式为____,b是____极(填“正”或“负”),b电极反应式为_____,a电极发生_____。(填“氧化反应”或“还原反应”)
②生产过程中H+向___(填 a 或 b)电极区域运动。
(2)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:_______,该燃料电池总反应式为:_____ ,电池在放电过程中溶液的pH将______(填“下降”或“上升”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
A. 甲、乙提高相同温度
B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强
D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com