
【题目】短周期两种元素X、Y能形成XmYn型化合物.回答下列问题
(1)当n=2时,若同周期元素X、Y的最外层电子数之和为13.常温下,XY遇水易水解,并能产生能使品红溶液褪色的气体和淡黄色的单质X沉淀。则:
①元素X在周期表中的位置是________。②XmYn中含有的化学键的类型是________。
a 共价键 b 离子键 c 金属键 d 氢键
③写出XmYn与水反应的化学方程式________。
(2)若XmYn是烃类化合物.则
①当n=2时,XmYn的结构式为________。1mol XmYn能与2mol H2反应生成乙,乙能与氯气在光照下发生化学反应,最多可生成________种有机产物(不考虑立体异构).
②当n=6时,写出芳香烃XmYn与浓硝酸、浓硫酸在50℃-60℃时的化学方程式________。
③当n=8时,芳香烃XmYn的球棍模型可表示为 ,写出由XmYn聚合生成的高分子化合物的结构简式________。
,写出由XmYn聚合生成的高分子化合物的结构简式________。
【答案】第三周期第VIA族 a 2S2Cl2+2H2O=SO2↑+3S↓+4HCl H-C≡C-H 9 ![]()
![]()
【解析】
(1)当n=2时,若同周期元素X、Y的最外层电子数之和为13,必有一种元素是 ⅦA族.常温下,XY遇水易水解,并能产生能使品红溶液褪色的气体和淡黄色的单质X沉淀,X为S,则Y为Cl。则:
①元素X为S,在周期表中的位置是第三周期第VIA族;
②S和Cl都是非金属元素,原子间通常通过共用电子对形成化学键,XmYn中含有的化学键的类型是共价键,故选a;
③XmYn与水反应O2、S、HCl生成化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl 。
(2)若XmYn是烃类化合物.则
①当n=2时,XmYn为乙炔,结构式为H-C≡C-H 。1mol XmYn能与2mol H2反应生成乙,乙为乙烷,乙烷能与氯气在光照下发生化学反应,乙烷的一氯取代物有1种,二氯取代物有2种,三氯取代物有2种,四氯取代物有2种(与二氯取代物个数相同),五氯取代物有1种(与一氯取代物个数相同),六氯取代物1种,所以共有9种。.
②当n=6时,芳香烃XmYn为苯,与浓硝酸、浓硫酸在50℃-60℃时反应生成硝基苯,化学方程式![]() ;
;
③当n=8时,芳香烃XmYn的球棍模型可表示为 ,得该物质为苯乙烯,由苯乙烯聚合生成的高分子化合物的结构简式
,得该物质为苯乙烯,由苯乙烯聚合生成的高分子化合物的结构简式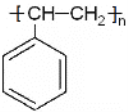 。
。


科目:高中化学 来源: 题型:
【题目】已知几种物质之间的能量关系如图所示, 下列说法中正确的是
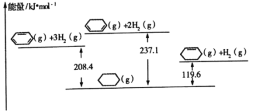
A.使用合适催化剂,能减小反应的焓变
B.![]() +H2(g)
+H2(g)![]()
![]() (g) ΔH=+28.7kJ/mol
(g) ΔH=+28.7kJ/mol
C.![]() (g)中,热能转化为产物内部的能量
(g)中,热能转化为产物内部的能量
D.![]() (g),反应物的总能量低于生成物的总能量
(g),反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。有如下两个实验都能用来制备乙烯请根据要求回答问题。
Ⅰ.已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。现有一课外活动兴趣小组拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.02mol CaC2的电石和1.600g含杂质18.75 %的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,测得G中收集到的水VmL(收集到的气体已经转化为标准状况下的体积)。
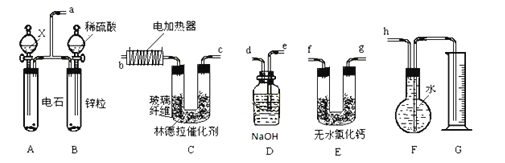
(1)试剂X为:_____。
(2)写出A中所发生反应的化学方程式(有机物写结构简式):_____。
(3)所用装置的连接顺序是_____(填各接口的字母)。
(4)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为_____。
Ⅱ.实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成 SO2、CO2、水蒸气等无机物。某研究性学习小组用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。
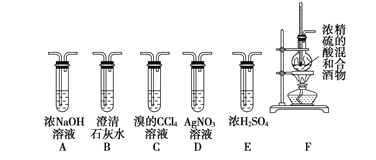
(1)为实现上述实验目的,装置的连接顺序为 F→_____→_____→_____→_____→D。(各装置限用一次),B装置的作用是_____。
(2)当C中观察到_____时,表明单质溴能与乙烯反应;若D中_______,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是_____反应,则D装置中溶液的作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学方程式:![]() 。在该反应中,破坏1mol EG中的化学键需吸收能量Q1,破坏1mol JL中的化学键需吸收能量Q2,形成1mol EL中的化学键需放出能量Q3,形成1mol JG中的化学键需放出能量Q4若该反应放出能量,则下列关系式一定正确的是( )
。在该反应中,破坏1mol EG中的化学键需吸收能量Q1,破坏1mol JL中的化学键需吸收能量Q2,形成1mol EL中的化学键需放出能量Q3,形成1mol JG中的化学键需放出能量Q4若该反应放出能量,则下列关系式一定正确的是( )
A.Q1+ Q2> Q3+ Q4B.Q1< Q3+ Q4C.Q2< Q3D.Q2< Q4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外观与氯化钠相似的亚硝酸钠(Na2NO2)在生活中应用十分广泛,如可用作建筑钢材缓蚀剂、肉制品发色剂等。已知:2NO+Na2O2=2NaNO2 2NO2+Na2O2=2NaNO3
I.某学习小组设计如图装置制备亚硝酸钠(夹持装置已省略)
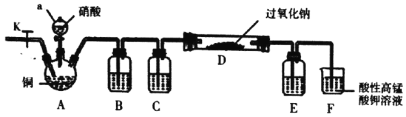
(1)仪器a的名称为________。
(2)装置B、C、E中的试制可选择___。
A 水、浓硫酸、浓硫酸
B 氢氧化钠溶液、浓硫酸、浓硫酸
C 酸性高锰酸钾溶液、浓硫酸、氢氧化钠溶液
D 水、浓硫酸、氢氧化钠溶液
(3)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡,该操作的目的是________。
(4)装置D中的实验现象是________。
(5)装置F中发生反应的离子方程式为________。
Ⅱ.工业上可以用烧碱溶液吸收硝酸厂的尾气制得亚硝酸钠。某学习小组设计如下实验方案测定该产品中亚硝酸钠的质量分数。取1.500g产品配成250mL溶液,取25.00mL溶液于锥形瓶中加入过量的稀硫酸和碘化钾溶液充分反应后,加入适当的指示剂,用0.1000mol/L Na2S2O3标准溶液进行滴定,记录数据如下表。
实验序号 | 1 | 2 | 3 |
Na2S2O3标准溶液体积/mL | 20.02 | 19.98 | 20.00 |
已知: 2NaNO2+2KI+2H2SO4 =2NO↑+I2+2H2O+Na2SO4+K2SO4 2Na2S2O3+I2=Na2S4O6+2NaI
(6)合适的指示剂是________
(7)该产品的纯度为________。
(8)经过讨论,同学认为该产品中可能含有硝酸钠,它会使测定结果________(填“偏高”、“偏低”、“无影响”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
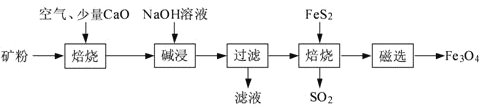
(1)粉碎高硫铝土矿石的目的是___。
(2)第一次焙烧时发生氧化还原反应:___。
(3)碱浸时发生反应的化学方程式为___。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为___;___。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类油脂及蛋白质的说法正确的是( )
A.相同质量的这三种物质在人体内被完全氧化时,糖类释放的能量最多
B.油脂中的碳链均为碳碳单键时,主要是低沸点的植物油
C.蛋白质仅由碳、氢、氧三种元素组成
D.淀粉、纤维素及蛋白质均能发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com