
【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】有机物M只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
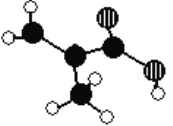
(1)有机物M的结构简式为__________________________,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有________种吸收峰。
(2)下列物质中,与有机物M互为同分异构体的是___(填序号),与有机物M互为同系物的是_______(填序号)。
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)M分子中最多有_________个碳原子共面,其中碳原子的杂化类型有___________。
(4)由M分子聚合可得到只含一种官能团的高分子化合物,写出该反应方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示的实验装置收集纯净的氨气,并探究氨气的性质。

(1)A装置中中发生反应的化学方程式为_______________。
(2)B装置的作用是_____________,y物质是_____________。
(3)C装置的作用是收集纯净的氨气,这种收集方法是____________。
(4)若D中装有湿润的红色石蕊试纸,则现象是____________。
(5) 若D中装有蘸有浓盐酸的布条,则现象是______________。
(6)E装置的作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1 mol该烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4 L,同时得到16.2 g水。
(1)该烃的摩尔质量为________。
(2)该烃的分子式为________。
(3)该烃有一种可能的结构为  ,属于________(选填序号)。
,属于________(选填序号)。
A.环烃 B.烷烃 C.芳香烃 D.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=___________;②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是____________(填字母)。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
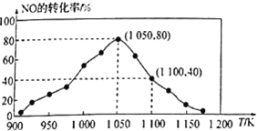
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为___________,在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________(已知:气体分压(P分)=气体总压(Pa)×体积分数)
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①达到平衡后,仅升高温度,k正增大的倍数____________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() = ____________。
= ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生如下反应:2A(g)+B(g)![]() 3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
A.用物质A表示该反应的平均速率为0.2mol·L-1·s-1
B.用物质B表示该反应的平均反应速率为0.2mol·L-1·s-1
C.平衡时物质A与B的转化率相等
D.平衡时物质B的浓度为0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
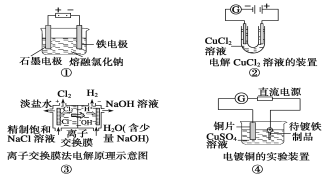
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
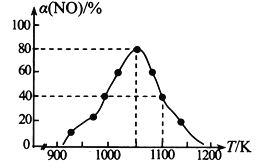
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
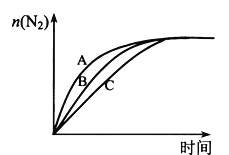
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1
2CO(g) ΔH=+172.5kJ·mol-1
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
请回答:
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
①0-2min内,用CO表示的反应速率v(CO)=___。
②CO2的平衡体积分数φ=___。
(2)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。CO2、CO的平衡分压(p)与温度(T)的关系如图所示(平衡分压=物质的量分数×总压强)。
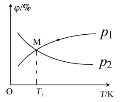
①能表示CO2的平衡分压与温度关系的曲线为___(填"p1”或“p2”),理由是___。
②温度为T1时,该反应的平衡常数K=___;温度升高,K___(填“变小”、“变大”或“不变”)
③实验测得,v正=v(CO2)消耗=k正c(CO2),v逆=v(CO)消耗=k逆c2 (CO),k正、k逆为速率常数,受温度影响,则温度为T1时,k正/k逆=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com