
【题目】以硫化铜精矿为原料生产CuCl的工艺过程如下:
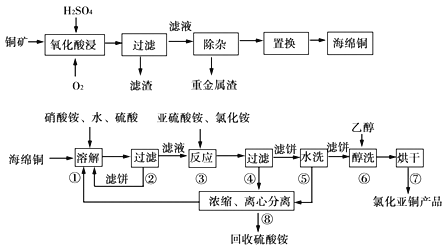
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的伓系,在潮湿空气中易水解氧化,海绵铜Cu中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量臼色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中![]() 为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(8)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7,溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为_____________
【答案】 CuS+2H2SO4+O2=CuSO4+S+2H2O CuSO4或Cu2+ 温度低溶解速度慢,温度过高铵盐分解 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+ 步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀 硫酸 醇洗有利于加快去除CuCl表面水分防止其水解氧化 4.72×10-7 ![]()
【解析】(1)硫化铜在酸性条件下被氧气把-2价的硫氧化为单质硫,化学方程式CuS+2H2SO4+O2=CuSO4+S+2H2O;正确答案:CuS+2H2SO4+O2=CuSO4+S+2H2O。
(2)步骤①中,铜在含有硝酸根离子的酸性环境下被氧化为铜离子,温度低溶解速度慢,温度过高铵盐会分解,故要将温度应控制在![]() ;正确答案:CuSO4或Cu2+ ;温度低溶解速度慢,温度过高铵盐分解。
;正确答案:CuSO4或Cu2+ ;温度低溶解速度慢,温度过高铵盐分解。
(3)亚硫酸铵将![]() 还原为
还原为![]() ,
,![]() 与
与![]() 结合生成
结合生成![]() 沉淀,离子方程式:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;正确答案:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+。
沉淀,离子方程式:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;正确答案:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+。
(4)步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀;正确答案:步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀。
(5)CuCl会溶于氯离子浓度较大的体系,为了减少CuCl溶解,同时为了回收硫酸铵,采用硫酸酸洗。正确答案:硫酸。
(6)酸洗后CuCl表面会有水分,烘干时![]() 会水解氧化,醇洗有利于加快去除CuCl表面水分防止其水解氧化;正确答案:醇洗有利于加快去除CuCl表面水分防止其水解氧化。
会水解氧化,醇洗有利于加快去除CuCl表面水分防止其水解氧化;正确答案:醇洗有利于加快去除CuCl表面水分防止其水解氧化。
(7)![]() =c(Ag+)c(I-)/ c(Ag+)c(Cl-)= Ksp(AgI)/ Ksp(AgCl)= 8.5×10-17/1.8×10-10=.4.72×10-7;正确答案:4.72×10-7。
=c(Ag+)c(I-)/ c(Ag+)c(Cl-)= Ksp(AgI)/ Ksp(AgCl)= 8.5×10-17/1.8×10-10=.4.72×10-7;正确答案:4.72×10-7。
(8)氯化亚铜与氯化铁发生Fe3++CuCl=Fe2++Cu2++Cl-,加入K2Cr2O7溶液,n(Cr2O72-)=amol/L×b×10-3L=ab×10-3mol,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,设CuCl的物质的量为n,反应的关系式为:
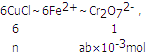
n=6ab×10-3mol,m(CuCl)=99.5g/mol×6ab×10-3mol=0.597ab g,则样品中CuCl的质量分数为![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】 230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.230Th和232Th的化学性质相同
C.232Th转化成233U是化学变化
D.Th元素的相对原子质量是231
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
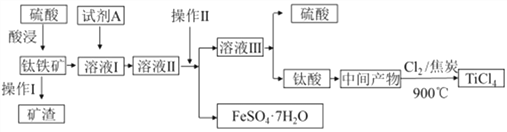
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与不同浓度的硫酸反应时,硫酸的还原产物为SO2或H2。为验证这一事实,某同学用下图装置在室温下进行实验。
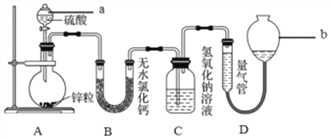
请回答下列问题:
(1)仪器a的名称是_________,若在圆底烧瓶中放入1.0g锌,选用量气管的适宜规格是(按标况计算)_____ (填字母序号)。
A.200mL B.300mL C.400mL D.500mL
(2)按上图连接好装置后,检查A装置气密性的操作是____,为使仪器a中的硫酸顺利加入圆底烧瓶,应_____并旋转活塞。
(3)实验发现:1.0g锌完全溶解后氢氧化钠洗气瓶增重0.8g,写出圆底烧瓶中发生反应的化学方程式:_________________。
(4)若ag锌与cmol/L的硫酸VL充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中, ![]() =______(用含字母的代数式表示), 若撤走B装置,
=______(用含字母的代数式表示), 若撤走B装置, ![]() 的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
(5)为准确测量气体体积,量气管在读数时应注意的操作有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物![]() 说法错误的是( )
说法错误的是( )
A. 1mol该化合在一定条件下加氢最多可消耗5mol H2
B. 该化合物最多有14个原子共面
C. 该化合物能使酸性高锰酸钾溶液褪色
D. 该化合物与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于有机物的是( )
①酒精 ②食盐 ③石墨 ④甲烷 ⑤红糖 ⑥水 ⑦一氧化碳 ⑧石灰石 ⑨脂肪 ⑩纤维素
A.①②④⑤⑨B.①④⑤⑨⑩
C.①③④⑤⑦⑧⑨⑩D.①④⑤⑥⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是
A.蛋白质最终能水解成氨基酸B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物D.葡萄糖不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某溶液由Na+、CO32-、SO42-、Ca2+、Cl- 中的几种离子组成,现进行如下实验:
①取5mL待测液分成两份;
②第一份滴加BaCl2溶液,有白色沉淀产生,再加过量稀HNO3,沉淀全部溶解;
③第二份滴加AgNO3溶液,有白色沉淀产生,再加过量稀HNO3,沉淀部分溶解,同时有无色无味的气体产生。
回答下列问题:
(1)该溶液中一定含有的离子有_________________;一定不含有的离子有____________________。
(2)写出②中白色沉淀溶解的离子方程式___________________________________。
(二)①一定温度下,向体积相同的三个密闭容器中,分别充入CH4、O2、O3,测得容器内气体密度均相同,则三个容器中气体压强之比为P(CH4):P(O2):P(O3)=_____________________。
②标准状况下,1体积的水溶解500体积的HCl气体,若所得溶液密度为1.19g/cm3,则所得盐酸溶液的物质的量浓度为_____________mol/L(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是

A. 该操作流程可用于分离水与四氯化碳
B. 操作I-定是过滤,目的是将固液分离
C. 可以用于从四氯化碳中提取碘单质
D. 可以提纯含少量BaSO4的NaCI固体混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com