


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州市邗江区高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)CO2可转化成有机物实现碳循环。
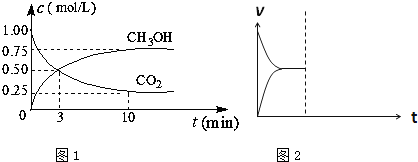
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。

分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)
 CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com