
| A、CH3Cl不存在同分异构现象 |
| B、CH2Cl2不存在同分异构现象 |
| C、CHCl3不存在同分异构现象 |
| D、CH4是气体分子 |


科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、易溶于水 |
| B、与澄清石灰水反应产生白色沉淀 |
| C、与足量盐酸反应放出气体 |
| D、属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先装好药品,后检查装置的气密性 |
| B、先用双手握紧试管,后将导管插入水中以检查装置的气密性 |
| C、开始氢气还原氧化铜的实验时,先通入一段时间的氢气,再加热 |
| D、稀释硫酸时,先在烧杯里倒入水,再小心例入浓硫酸并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
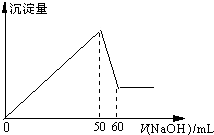 铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.
铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| A、445.15kJ/mol |
| B、607.3kJ/mol |
| C、890.3kJ/mol |
| D、802.3kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com