
����Ŀ��������Ҫ��ش�
��1����֪��CH2=CH2+KMnO4+H2SO4��CO2+K2SO4+MnSO4+H2O��δ��ƽ�������ϣ�480mL0.1000molL��1����KMnO4��Һ��������ϩmL����״������
��2��ʵ����������KMnO4����������480mL 0.1000molL��1������KMnO4��Һ�� �����õ���������ƽ��ҩ�ס��ձ�������������Ͳ��
�����в����ᵼ������KMnO4��ҺŨ��ƫ�ߵ���������ţ���
a����ˮ����ʱ���ӿ̶���
b��ת��ϴ��Һʱ��������ƿ�⣬�����ø�δ��ϴ������ƿ��������
c������ƿ�ײ�����������ˮ
��3����ͼ��ʾװ�õ������Լ���У�һ��©������������ţ��� 
��4��W��X��Y��Z�������ڱ���ǰ20��Ԫ�أ���֪�� ��A�� W�������Ӻ�Y�������Ӿ�����ͬ�ĺ�������Ų��������γ����ΪWY�Ļ����
��B�� Y��Z��ͬ��Ԫ�أ��������γ����ֳ��������
��C�� X��Z��ͬһ����Ԫ�أ��������γ�������̬�����
��D�� X��Y����ͬһ���ڣ��������γ����ΪXY2�ķǼ��Է��ӣ�
��ش�
��WԪ������ZԪ���� ��
�ڻ�����WY�ĵ���ʽΪ ��
��Y��Z�γɵ����ֳ���������ķ���ʽ���� ��
��д��X��Z�γɵ�һ����̬�������WZ��Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��480
��2����ͷ�ιܡ�500mL����ƿ��a
��3��D
��4���ƣ�����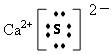 ��SO2��SO3��CO2+CaO=CaCO3
��SO2��SO3��CO2+CaO=CaCO3
���������⣺��1����ϩ��CԪ�ػ��ϼ�Ϊ��2�ۣ����������ɶ�����̼��Ԫ�ػ��ϼ�����6�ۣ�MnԪ�ػ��ϼ���+7�۽��͵�+2�ۣ�n��KMnO4��=0.48L��0.1mol/L=0.048mol�� �õ����ӵ����ʵ���Ϊ0.048mol��5=0.24mol����n��CH2=CH2��= ![]() =0.02mol��V=0.02mol��22.4L=0.48L=480mL��
=0.02mol��V=0.02mol��22.4L=0.48L=480mL��
���Դ��ǣ�480����2��Ӧ����500mL����Ҫ�������ܽ⡢��Һ�����ݵȲ��������õ���������ƽ��ҩ�ס��ձ�������������Ͳ����ͷ�ι��Լ�500mL����ƿ��
a����ˮ����ʱ���ӿ̶��ߣ��������ƫС����Ũ��ƫ����ȷ��
b��ת��ϴ��Һʱ��������ƿ�⣬�����ø�δ��ϴ������ƿ�������ƣ�����Ũ��ƫС���ʴ���
c������ƿ�ײ�����������ˮ����ʵ��û��Ӱ�죬�ʴ���
���Դ��ǣ���ͷ�ιܡ�500mL����ƿ��a����3��A��������ס�Թܣ��Թ��������������ͣ����ձ��������ݲ�����˵��װ�����������ã���A��©����
B���õ��ɼм�ס�ұߵ��ܣ���©���е�ˮ��Һ��߶Ȳ��䣬˵��װ�����������ã���B��©����
C���õ��ɼм�ס�ұߵ��ܣ�˫����ס��ƿ����ƿ�������������ͣ�ʹ����ƿ������ѹǿ�����ڲ��������γ�һ��ˮ����˵��װ�����������ã���C��©����
D���õ��ɼм�ס�ұߵ��ܣ������ƶ�����װ�ò�©��������Һ��Ӧ�γ�һ���ĸ߶Ȳ��ͼʾ����Һ����ƽ��˵��װ��©����
���Դ��ǣ�D����4���������Ϸ�����֪WԪ���Ǹƣ�ZԪ�����������Դ��ǣ��ƣ������ڻ�����WYΪCaS��Ϊ���ӻ��������ʽΪ  �����Դ��ǣ�
�����Դ��ǣ�  ����Y��Z�γɵ����ֳ���������ķ���ʽ��SO2��SO3 �� ���Դ��ǣ�SO2��SO3����д��X��Z�γɵ�һ����̬�������WZ��Ӧ�Ļ�ѧ����ʽΪCO2+CaO=CaCO3 �� ���Դ��ǣ�CO2+CaO=CaCO3 ��
����Y��Z�γɵ����ֳ���������ķ���ʽ��SO2��SO3 �� ���Դ��ǣ�SO2��SO3����д��X��Z�γɵ�һ����̬�������WZ��Ӧ�Ļ�ѧ����ʽΪCO2+CaO=CaCO3 �� ���Դ��ǣ�CO2+CaO=CaCO3 ��
�����㾫����������Ĺؼ�������������һ�����ʵ���Ũ�ȵ���Һ�����֪ʶ�������������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��ߣ�


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦH2(g)+Br2(l)=2HBr(g)��25 ����101 kPa�½���,�ų�����Ϊ72 kJ,����1 mol Br2(l)��Ҫ���յ�����Ϊ30 kJ����������������±�:
H2(g) | Br2(g) | HBr(g) | |
1 mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | a | 369 |
�����aΪ( )��
A.404B.260C.230D.200
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�KNO3������ȷ���ǣ� ��
A.�����ӽṹʾ��ͼ�� 
B.KNO3��Һ�У�H+��Na+��Br����I���ܴ�������
C.�������������Ϸʡ�����ըҩ��������Բ�ҩ
D.KNO3��Һ�л�������NaClʱ�������ؽᾧ�ķ����ᴿ��ԭ����KNO3�ܽ�ȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019����������յ��й�����������ϧ������Դ��ת�䷢չ��ʽ��������̼������������˵����ȷ����(����)
A.�������ദ����ʵ����Դ������B.���շϾ����ϣ���������ɫ��Ⱦ��
C.���ٶ�����̼�ŷţ���ֹ�γ�����D.ʩ�ô���ũҩ�����ũ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W����A��B����Ԫ����ɵ�AB2�ͻ����
��1����W�ͽ�̿�ڸ����·�����Ӧ�����Ƶõİ뵼�����Ӧ�ù㷺����WΪ���ѧʽ����
��2����ȡ��֧�Թֱܷ��������W��Һ����һ֧�Թ��е���KSCN��Һ������������ ����һ֧�Թ��м���������ˮ���ټ�������CCl4 �� �����ã��²���Һ���Ϻ�ɫ�����ϲ���Һ�е���KSCN��Һ����Һ�ʺ�ɫ��
��W��Һ����������������Ϊ
������ʵ���У�W��������ˮ��Ӧ�����ӷ���ʽΪ��
��3����W�����ӻ���������������Ӿ���18�����ӣ������������Ӹ�����Ϊ1��1�� �������ӵĵ���ʽΪ ��
��1mol W������ˮ��ַ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊmol
��4����A��B��ͬ����Ԫ�أ�W����ˮ����һ�ֶ�Ԫ���ᣮ ��B��Ԫ�����ڱ��е�λ��Ϊ
�����AԪ�ص�����������BԪ�ص�������W��ˮ��Һ��˫��ˮ�����Ļ�ѧ����ʽΪ��
��5������ͼ��ʾ0.5molW ��g����0.5mol CO��g����Ӧ����CO2��g����NO��g�������е������仯����÷� Ӧ���Ȼ�ѧ����ʽΪ�� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ�ɱ�ʾΪ��xCuCO3yCu��OH��2zH2O���ⶨ��ʽ̼��ͭ��ɵķ����ж��֣�
��1���ֲ���������ԭ������ش��������⣺
��д��xCuCO3yCu��OH��2zH2O��������Ӧ�Ļ�ѧ����ʽ��
������װ�������������������Ӷ��ɣ������������������˳���ǣ����������ӿ���ĸ��ţ���
��a����������������l��
�۳�ȡ23.9gij��ʽ̼��ͭ��Ʒ����ַ�Ӧ��õ�12.7g���������4.4g������̼��7.2gˮ������Ʒ�Ľᾧˮ����Ϊ g����ѧʽΪ��
��2��ijͬѧ�Ե���������������������ȫ�����������ⶨ��ʽ̼��ͭ����ɣ�����Ϊ�Ƿ���У���˵�����ɣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu��Znϡ�������ԭ���װ�ã�����������0.5mol����ͨ��ʱ�������������ı仯�ǣ� �� ��п����Ӧ��Zn��2e��=Zn2+ �� пƬ�ϲ���0.25mol��H2
��ͭ����Ӧ��2H++2e��=H2����пƬ�ܽ�16.25g
�۵�����ͭ������������п��
����Һ��SO42������ͭ����
A.�٢�
B.�ۢ�
C.�ڢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mL���۽����5mL�Ȼ�����Һ��Ϻ����ð�Ĥ�ƳɵĴ��ڣ����˴���������ˮ�У���ͼ��ʾ��2min�ֱ�ȡ���ں��ձ���Һ�����ʵ�飮����˵����ȷ���ǣ�������
A.�ձ���Һ�������������Һ���а�ɫ��������
B.�ձ���Һ������ˮ�����ɫ
C.����Һ�������������Һ����ְ�ɫ����
D.����Һ������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������£�����л���ˮ����CH3COOH����ʵ�ַ�ˮ������ͬʱ���ɻ�������ԴH2 �� ��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� �� 
A.�缫AΪ����
B.��������ɵ�CO2��H2���ʵ���֮��Ϊ1��1
C.������ӦΪ��CH3COOHһ8e��+8OH���T2CO2��+6H2O
D.���ǰ�������ҵ�pH�������ֲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com