

| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
分析 ①聚氯乙烯和苯分子中不含有碳碳双键;
②苯不能使酸性KMnO4溶液褪色;
③苯环为平面结构,Cl与苯环直接相连;
④-C3H6Cl与甲基有邻、间、对三种,且-C3H6Cl有5种同分异构体;
⑤葡萄糖为单糖,不能发生水解反应;
⑥高分子中含-COOC-,二氧化碳的结构式为O=C=O;
⑦乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,根据氧元素质量分数计算C、H元素质量分数之和,进而计算氢元素质量分数.
解答 解:①聚乙烯为氯乙烯的加聚产物,不含碳碳双键,且苯不含双键,只有乙烯含碳碳双键,故错误;
②油脂含有碳碳双键,可被氧化,可使高锰酸钾溶液褪色,故错误;
③氯苯具有苯的结构特征,所有的原子在同一个平面上,故正确;
④-C3H6Cl在甲苯苯环上位置有3种情况,-C3H6Cl中碳链异构为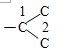 和
和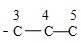 ,数字编号为Cl的位置,因此-C3H6Cl异构情况为5种,故同分异构体的种类为3×5=15,故错误;
,数字编号为Cl的位置,因此-C3H6Cl异构情况为5种,故同分异构体的种类为3×5=15,故错误;
⑤葡萄糖为单糖,不能发生水解反应,乙酸乙酯、蛋白质可发生水解反应,故错误;
⑥由结构简式可知全降解塑料(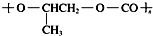 )可由单体环氧丙烷(
)可由单体环氧丙烷(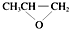 )和CO2加聚制得,故正确;
)和CO2加聚制得,故正确;
⑦乙烯的分子式为C2H4,甲醛的分子式为CH2O,两物质中C、H原子数目之比都是1:2,故混合物中C、H元素质量之比=12:2=6:1,含氧的质量分数为a,则C、H元素质量分数之和=1-a,故H元素质量分数=(1-a)×$\frac{1}{1+6}$=$\frac{1-a}{7}$,生成水的质量为14g×$\frac{1-a}{7}$×$\frac{1}{2}$×18=18(1-a)g,故正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意同分异构体的判断及高分子的合成方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 10.7gNH4C1中含有的共用电子对数为NA | |
| B. | 0.5mol•L-1CH3COONa溶液中含有CH3COO-的数目少于0.5 NA | |
| C. | 22gN2O和22gCO2所含有的质子数均为11NA | |
| D. | 足量的镁与一定量的浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
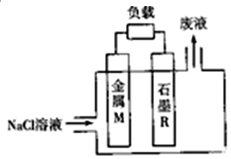 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )| A. | 电池工作时,电子沿M电极→电解质溶液→R电极流动 | |
| B. | 电池工作时,正极附近溶液的pH增大 | |
| C. | 在锌、铁、铝、锂中,锂的比能量最高 | |
| D. | 若M为锌时,电池反应为 Zn+2H2O═Zn(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
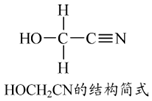 锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:
锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题: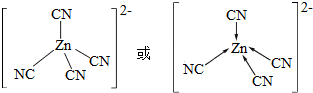 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | Ba(OH)2、Na2SO4、Na3PO4 | ||
| C. | Na2CO3、HNO3、MgO | D. | HCl、Al2O3、MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com