
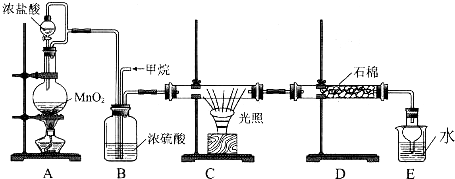
| ||
| ||


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������п�̵���Ƕ��ε�� |
| B��MnO2�����˻�ԭ��Ӧ |
| C����Ӧ���� 0.65gZn����0.01 mol���ӷ���ת�� |
| D����������ķ�ӦΪ��Zn+2 OH--2e-=Zn��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ʵ����� | ʵ������ |
| �� | ȡ������ɫ��ĩX�����Թ�1�У�ע��Ũ���ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ�ʻ���ɫ�������ݲ��� |
| �� | ���Թ�1�еμӼ���KSCN��Һ���� | ��Һ����Ѫ��ɫ |
| �� | ��ȡ������ɫ��ĩX�����Թ�2�У�ע����������ͭ��Һ�������� | �м�������ɫ�������������н϶��ɫ����δ�ܽ� |
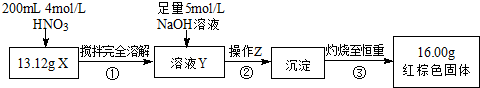
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
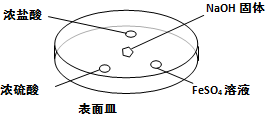
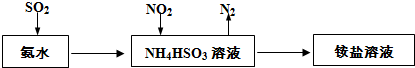
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
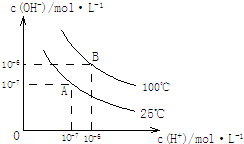 ��ˮ�ĵ���ƽ���У�c��H+����c��OH-���Ĺ�ϵ��ͼ��ʾ��
��ˮ�ĵ���ƽ���У�c��H+����c��OH-���Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ܽ�� | B�����ʵ���Ũ�� |
| C���������� | D��Ħ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com