
| A. | 1 mol 羟基(-OH)含有的电子数为10 NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成H2的分子数为0.3 NA | |
| C. | 7.8 g Na2S、Na2O2的固体混合物中含有的阴离子数为0.1 NA | |
| D. | 用惰性电极电解饱和食盐水,电路中通过NA个电子,则阳极产生气体11.2 L |
分析 A.羟基中含有9个电子,1mol羟基中含有9mol电子;
B.铁与水蒸气反应生成四氧化三铁,产物中Fe元素的化合价为+$\frac{8}{3}$,据此计算出转移电子数;
C.过氧化钠与硫化钠的摩尔质量都是78g/mol,过氧化钠中含有2个钠离子和1个过氧根离子,据此计算出混合物中含有的阴离子数目;
D.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.羟基为中性原子团,1 mol 羟基(-OH)含有9mol电子,含有的电子数为9NA,故A错误;
B.铁与水蒸气反应生成四氧化三铁,产物中Fe元素的化合价为+$\frac{8}{3}$,0.2molFe完全反应转移电子的物质的量为:0.2mol×($\frac{8}{3}$-0)=$\frac{8}{15}$mol,转移电子数为$\frac{8}{15}$NA,故B错误;
C.7.8g Na2S、Na2O2的固体混合物的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,Na2O2的阴离子为过氧根离子,则0.1mol该混合物中含有的阴离子为0.1mol,含有的阴离子数为0.1 NA,故C正确;
D.电路中通过NA个电子,转移了1mol电子,阳极生成的是氢气,根据电子守恒阳极生成了0.5mol氢气,由于不是标准状况下,不能使用标准状况下的气体摩尔体积计算0.5mol氢气的体积,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
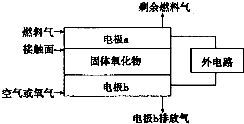 已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.
已知氮元素有多种化合价,如:-3、0、+1、+2、+3、+4、+5.| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
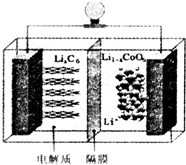 随着各地“限牌”政策的推出,电动汽车成为汽车族的“新宠”.某电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车族的“新宠”.某电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 放电时,正极锂的化合价未发生改变 | |
| B. | 充电时Li+移动方向:右室→左室 | |
| C. | 放电时负极的电极反应式:LixC6-xe-═C6+xLi+ | |
| D. | 充电时阳极的电极反应式:Li1-xCoO2+xLi++xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的水处理剂,可以淡化海水 | |
| B. | 中国新型“鹘鹰”战斗机上使用的碳纤维是一种新型无机高分子材料 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 葡萄酒中常添加极少量SO2,有防止葡萄酒氧化变质等作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
 的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.
的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,如图是CO2平衡转化率(α) 与氨碳比(x)的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与NaOH溶液反应放出H2 | B. | 不能与硫酸铜溶液反应 | ||
| C. | 在常温下不能与O2反应 | D. | 遇冷浓硫酸不发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 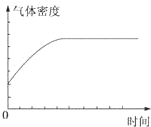 | B. | 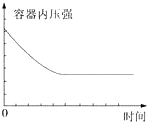 | ||
| C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com