
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| D. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
分析 A.二氧化硫与水反应生成亚硫酸,亚硫酸为弱酸,应保留化学式;
B.用铜电解稀硫酸溶液反应生成硫酸铜和氢气;
C.铁与氯气反应生成氯化铁,钠与氧气加热生成过氧化钠,铜与硫单质反应生成硫化亚铜;
D.依据碘离子还原性强于二价铁离子,二价铁离子强于溴离子解答.
解答 解:A.SO2使紫色石蕊溶液变红色:SO2+H2O═H2SO3,故A错误;
B.用铜电解稀硫酸溶液反应生成硫酸铜和氢气,方程式:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑,故B错误;
C.铁与氯气反应生成氯化铁,钠与氧气加热生成过氧化钠,铜与硫单质反应生成硫化亚铜,故C正确;
D.氯气通入溴化亚铁溶液,先氧化二价铁离子生成三价铁离子,该反应不是置换反应,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉相关物质的性质及氧化还原反应强弱规律、电解池工作原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 干燥的氯气能使湿润的有色布条褪色 | |
| B. | 影响气体体积大小的主要因素是微粒间的距离与微粒的大小 | |
| C. | 汤姆生发现原子中存在电子,并提出了“葡萄干面包式”原子结构模型 | |
| D. | 干冰升华的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2v(O2)=v(NO2) | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO2 | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均相对分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
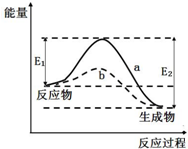
| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
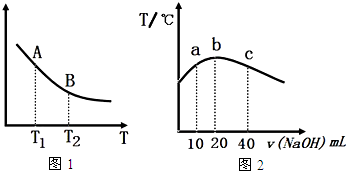 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
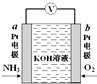 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 负极的电极反应式为:2NH3-6e-+6OH-═N2↑+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别取固体样品,滴加同浓度盐酸,观察产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 所加试剂 | 主要操作 |
| 除去NaCl溶液中混有的I2 | 苯或四氯化碳 | 萃取、分液 |
| 除去NO气体中混有的NO2 | 水 | 洗气 |
| 除去SiO2固体中混有的Al2O3 | 盐酸 | 过滤 |
| 除去Fe2(SO4)3溶液混有的FeSO4溶液 | 过氧化氢 | ------ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
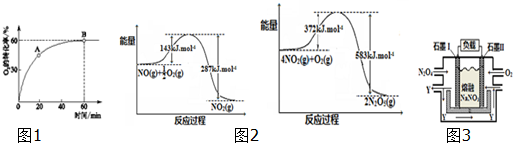
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com