
| A. | 前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol•L-1•s-1 | |
| B. | 4 s时容器内的压强为开始时的1.2倍 | |
| C. | 平衡时容器内含0.4 mol N2O4 | |
| D. | 平衡时容器内含0.8 mol NO2 |
分析 A.根据v=$\frac{△c}{△t}$计算前4 s以N2O4的浓度变化表示的平均反应速率;
B.计算出反应后气体总物质的量,根据一定条件下反应前后的物质的量之比等于压强之比计算;
C.利用平衡时容器内压强为开始时的1.8倍来计算平衡时各物质的物质的量;
D.根据C的计算结果得出平衡时容器NO2的物质的量.
解答 解:A.前4s中以NO2的浓度变化表示的平均反应速率为:$\frac{0.04mol/L}{4s}$=0.01mol/(L•s),则以N2O4的浓度变化表示的平均反应速率为0.005mol/(L•s),故A错误;
B.N2O4 ?2NO2
初始浓度:0.1 0
变化浓度:0.02 0.04
4s时浓度:0.08 0.04
在4s时容器内的压强和开始时的压强之比为:$\frac{0.08+0.04}{0.1}$=1.2,故B正确;
C.反应达平衡时容器内压强为开始时的1.8倍,设N2O4的转化率为x,
N2O4?2NO2
初始浓度:0.1 0
变化浓度:x 2x
平衡浓度:0.1-x 2x
则:$\frac{0.1-x+2x}{0.1}$=1.8,
解得:x=0.08,所以在平衡时容器内含N2O4物质的量为:(0.1-0.08)×10mol=0.2mol,故C错误;
D.平衡时容器内含NO2物质的量为:2×0.08×10mol=1.6mol,故D错误;
故选B.
点评 本题考查化学平衡的计算,题目难度中等,明确信息中的压强关系及不同时间混合体系中各物质的物质的量的关系是解答的关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
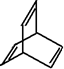 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为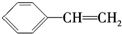 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
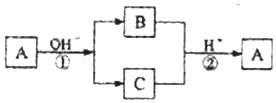
| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | n(N) | ||
| ① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
| ② | 800 | 0.20 | 0.80 | a | a |
| ③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
| A. | 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=12.5 | |
| C. | 实验②中,达到平衡时,a大于0.16 | |
| D. | 正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃,1.01×105Pa下 11.2LN2含有的分子数为3.01×1023 | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,lmol NO与lmol N2和O2的混合气体的体积不相等 | |
| D. | 0℃、1.01×10sPa时,11.2L氧气所含的原子数目为3.01×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com