
����Ŀ����ҵ�ϳ������µķ����Ӻ�ˮ�����壺
Ũ����ˮ![]() �ֲ�Ʒ��
�ֲ�Ʒ��![]() ������
������![]() ����X
����X ![]() ��Ʒ��
��Ʒ��
���������գ�
��1���������������������漰�����������������������Ļ�ѧ�������ǣ�_____���嵥�ʵĵ���ʽ��_________���������̬�⻯��ķе�Ƚϣ�___________>___________����д��ѧʽ����д��һ�ֺ���Ԫ�صĻ����������ڷǼ��Է��ӵĻ�ѧʽ_____��
��2����������������嵥�ʾ��е�������_____��
��3��д��������з�Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ����˵������Ӧ��ˮ���������������ɣ���_____���ڸ÷�Ӧ�б�������Ԫ���ǣ�_____��
��4����ҵ�����ú�ˮ����һ����Ҫ�ķ�Ӧ���ǵ�ⱥ��ʳ��ˮ���˷�Ӧ�е����������ǣ�_____��______________��д��ѧʽ����
���𰸡����ۼ� ![]() HBr HCl CCl4 �е��
HBr HCl CCl4 �� 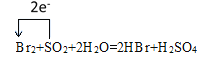 S NaOH H2
S NaOH H2
��������
��1��±�ص������ڹ��۷��ӣ������д��ڹ��ۼ���±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ�CCl4���ڷǼ��Է��ӣ�
��2������зе�ͣ��ӷ������ʣ�
��3���������Ͷ�������Ӧ�����������������ݷ�Ӧ��1molSO2��ȫ�������������֪��ת��2mol���ӣ�����÷�Ӧ�е���ת�Ƶķ������Ŀ����Ӧ��������Ԫ�ػ��ϼ����ߣ�������������Ӧ��
��4����ⱥ��ʳ��ˮ�ķ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+ H2��������������ԭ��Ӧ���ݴ˷��������IJ��
2NaOH+Cl2��+ H2��������������ԭ��Ӧ���ݴ˷��������IJ��
��1���������ɷǽ���Ԫ����ɣ���ԭ�Ӻ���ԭ��֮����ڵ��ǹ��ۼ�������8�����ȶ��ṹ���Եó����嵥�ʵĵ���ʽΪ![]() ��±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ��ʷе�HBr>HCl��CCl4�Ǻ���Ԫ�صĻ����������ڷǼ��Է��ӣ�
��±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ��ʷе�HBr>HCl��CCl4�Ǻ���Ԫ�صĻ����������ڷǼ��Է��ӣ�
�ʴ��ǣ����ۼ���![]() ��HBr��HCl��CCl4��
��HBr��HCl��CCl4��
��2�������ͨ��ͨ�������ˮ��������Һ̬��������������������е�ͣ��ӷ������ʡ�
�ʴ��ǣ��е�ͣ�
��3����������������Ͷ�������Ӧ���仯ѧ����ʽΪ��Br2+SO2+2H2O=2HBr+H2SO4��+4�������ߵ�+6�ۣ�����1molSO2��ȫ������ת��2mol���ӣ�����ת�Ƶķ������ĿΪ��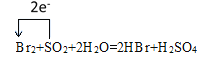 ���ڸ÷�Ӧ��SԪ�صĻ��ϼ۷����˱仯���ɶ��������е�+4���������е�+6�ۣ���˱�������Ԫ����S��
���ڸ÷�Ӧ��SԪ�صĻ��ϼ۷����˱仯���ɶ��������е�+4���������е�+6�ۣ���˱�������Ԫ����S��
�ʴ��ǣ� 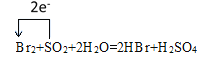 ��S��
��S��
��4����ⱥ��ʳ��ˮ�ķ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+ H2��������������ԭ��Ӧ�����������������ĵ缫����ʽ��2H2O+2e��=H2��+2OH- ��������Ũ�ȼ�С�������������������������������ƣ�����������ΪNaOH��H2��
2NaOH+Cl2��+ H2��������������ԭ��Ӧ�����������������ĵ缫����ʽ��2H2O+2e��=H2��+2OH- ��������Ũ�ȼ�С�������������������������������ƣ�����������ΪNaOH��H2��
�ʴ��ǣ�NaOH��H2��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1������Fe��2HCl===FeCl2��H2�����ı��������������������������к�Ӱ�죿(���������С�����䡱)
�������¶ȣ�________��
���������������____________��
�ۼ���������NaCl��Һ��__________��
�ܵ��뼸��CuSO4��Һ��____________��
��2��һ���¶��£���ӦN2(g)��O2(g) ===2NO(g)���ܱ������н��У��ش����д�ʩ�Ի�ѧ��Ӧ���ʵ�Ӱ�졣(���������С�����䡱)
����С���ʹѹǿ����__________��
�ں��ݳ���N2��__________��
�ۺ�ѹ����He��__________��
��3�����淴ӦA(g)��B(g) C(g)��D(g)���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ__________(����ȷѡ��ǰ����ĸ)
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
��4��һ���¶��£���2 L���ܱ������У�X��Y��Z�������������ʱ��仯��������ͼ��ʾ��
�ٴӷ�Ӧ��ʼ��10 sʱ����Z��ʾ�ķ�Ӧ����Ϊ________��X�����ʵ���Ũ�ȼ�����________��Y��ת����Ϊ________��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��������������ͭ��Һ���ԭ��أ������Ϸ����ķ�ӦΪ�� ��
A. Fe��2e��===Fe2��B. Cu2����2e��===Cu
C. Fe��3e��===Fe3��D. Zn��2e��===Zn2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Fe(OH)3(s)��Cu(OH)2(s)�ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���ҺpH������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ������
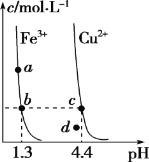
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. ������NH4Cl�����ʹ��Һ��a��䵽b��
C. c��d�����������Һ��c(H��)��c(OH��)�˻����
D. ��b��c�����������Һ��Fe(OH)3��Cu(OH)2�ֱ�ﵽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������8�־��壬����Żش��������⣺
A��ˮ�� B������ C�������� D����̬� E���Ȼ�� F���� G�����ʯ
��1�����зǼ��Լ���ԭ�Ӿ�����_________ ,����ԭ�Ӿ���Ļ�������_______��������ѧ���ķ��Ӿ����� _______�����ڷ��Ӿ���ĵ�����_________
��2���������Ӽ������ۼ�����λ���Ļ�������___________�������ۻ�����˷����ۼ�����___________��
��3�����ɰ��SiC���Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱������ɰ�ľ����к���_____����ԭ�ӣ�______��̼ԭ�ӣ����ʯ�۵���ڽ��ɰ��ԭ��_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����̼����ﴦ����Cu2+��ˮ��ý���ͭ����������м�ͻ���̿����������ʱ����÷�ˮ��Cu2+Ũ���ڲ�ͬ��̼������(x)��������ʱ��仯����������ͼ��ʾ��

������������������
A. ����̿��Cu2+����һ������������
B. ��м�ͻ���̿������Һ���γ���أ���Ϊ����
C. ������̼���������̼��(x)��һ������߷�ˮ��Cu2+��ȥ������
D. ������̼�������պ�Cu2+��ˮ��ͭ�ķ�Ӧԭ����Fe+Cu2+��Fe2++Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李���������李��߰�ˮ����ش��������⣺
��1���١��ڡ��ۡ���������Һ����ˮ�������H��Ũ���ɴ�С��˳����(�����)___________��
��2���ܡ��ݡ��ޡ���������Һ��NH![]() Ũ���ɴ�С��˳����(�����)_______________��
Ũ���ɴ�С��˳����(�����)_______________��
��3�����ۺܰ͢������1��2��Ϻ��Һ�и�����Ũ���ɴ�С��˳���ǣ�__________________��
��4����֪t ��ʱ��KW��1��10��13����t ��(�����������������)________25�档��t ��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L���(���Ի�Ϻ���Һ����ı仯)�������û����Һ��pH��2����a��b��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��2�����ӷ�Ӧ����1�������Ӻ�3���ҷ��ӣ��Դ������жϴ������

A.���ݰ����ӵ���������֪��1���ҷ����к���2��Aԭ��
B.�÷�Ӧ�����Ǹ��ֽⷴӦ
C.��Ӧ���ɵı��������ڵ���
D.��ѧ��Ӧ�з��ӵ�������˸ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3CuO+2NH3![]() 3Cu+N2+3H2O�������ж���ȷ����
3Cu+N2+3H2O�������ж���ȷ����
A.NԪ�صĻ��ϼ۽���B.NH3����ԭ
C.����0.3 mol CuOת��0.6 NA������D.CuO�ǻ�ԭ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com