
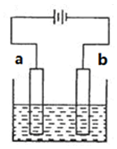
| A. | 精炼铜时,a极为粗铜,b极为精铜 | |
| B. | 电镀铜时,a极为镀件,b极为铜 | |
| C. | 保护铁时,a极为铁片,b极为锌片 | |
| D. | 惰性电极电解饱和食盐水时,b极有黄绿色气体产生 |
分析 A.精炼铜时,粗铜为阳极,纯铜为阴极;
B.电镀铜时,Cu为阳极;
C.保护铁时,Fe为阴极;
D.惰性电极电解饱和食盐水时,阳极上生成氯气.
解答 解:A.精炼铜时,粗铜为阳极,纯铜为阴极,a与正极相连,则a极为粗铜,b极为精铜,故A正确;
B.电镀铜时,Cu为阳极,则b极为镀件,a极为铜,a与正极相连,故B错误;
C.保护铁时,Fe为阴极,则b极为铁片,a极为锌片,故C错误;
D.惰性电极电解饱和食盐水时,阳极上生成氯气,则a极有黄绿色气体产生,故D错误;
故选A.
点评 本题考查电解原理及应用,为高频考点,把握电解原理、电极反应、电解应用为解答的关键,侧重分析与应用能力的考查,注意a与电源正极相连,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点高,可用作耐高温材料 | B. | SiO2能与HF反应,可用作光导纤维 | ||
| C. | KAl(SO4)2易溶于水,可用作净水剂 | D. | Fe2O3能与酸反应,可用作红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | OH-(aq)+H+(aq)=H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1(反应热) | |
| D. | 2NO2=O2+2NO△H=+116.2 kJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH>13 | |
| B. | 加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 该溶液中:c(OH-)=c(NH4+) | |
| D. | 完全中和等物质的量的HCl,消耗的体积与0.1 mol•L-1NaOH溶液一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 在强碱性溶液中:K+、Na+、CO3-、AlO2- | |
| C. | 在盐酸溶液中:K+、Fe2+、SO32-、NO3- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com