
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铝箔插入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
| D | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠在不加热条件下生成氧化钠;
B.常温下铝与浓硝酸发生钝化反应;
C.酸性条件下,硝酸根离子具有强氧化性,可氧化亚铁离子生成铁离子;
D.亚铁离子与高锰酸钾发生氧化还原反应.
解答 解:A.切开金属钠,钠表面的银白色会逐渐褪去,原因是钠在不加热条件下生成氧化钠,在加热条件下可生成过氧化钠,颜色为淡黄色,故A错误;
B.常温下铝与浓硝酸发生钝化反应,在表现生成一层致密的氧化铝膜,阻碍反应的继续进行,故B错误;
C.亚铁离子具有还原性,酸性条件下,硝酸根离子具有强氧化性,可氧化亚铁离子生成铁离子,故C正确;
D.亚铁离子与高锰酸钾发生氧化还原反应,氯化亚铁体现还原性,故D错误.
故选C.
点评 本题多角度考查元素化合物知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$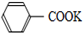 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅具有半导体的性质,所以可以制作光导纤维 | |
| B. | 燃煤中加入生石灰可以减少二氧化硫的排放 | |
| C. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| D. | 氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL | B. | 60mL | C. | 90mL | D. | 120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在进行焰色反应时,透过蓝色钴玻璃看到紫色火焰,证明含K+,不含Na+ | |
| B. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| C. | 向某无色溶液中加入稀盐酸后,再加入AgNO3溶液,产生白色沉淀,证明含Clˉ | |
| D. | 向某无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,证明含CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com