
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.![]() ?
?
B.![]()
C.c(H+)和c(OH﹣)的乘积
D.OH﹣的物质的量
【答案】B
【解析】解:A、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,则n(NH3 . H2O)减少,n(OH﹣)增大, ![]() 增大,故A错误;
增大,故A错误;
B、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,则n(NH3 . H2O)减少,n(OH﹣)增大, ![]() 减小,故B正确;
减小,故B正确;
C、因加水稀释时,温度不变,则c(H+)和c(OH﹣)的乘积不变,故C错误;
D、由NH3 . H2OOH﹣+NH4+可知,加水促进电离,OH﹣的物质的量增大,故D错误;
故选:B.
用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3 . H2OOH﹣+NH4+可知,n(OH﹣)增大,但溶液的体积增大的多,则c(OH﹣)减小,加水促进电离,则n(NH3 . H2O)减少.


科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,则下列有关说法中不正确的是( ) 
A.能发生加成、取代、氧化反应
B.1 mol该物质最多可与7mol NaOH反应
C.1 mol该物质最多可与6 mol H2反应
D.能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是
①lmolCH3CH2C(CH3)3所含甲基个数为4NA
②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA
④8.8g乙酸乙酯中含共用电子对数为1.4NA
⑤标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
⑥常温常压下,17g甲基(一14CH3)所含的中子数为9NA
⑦标准状况下,11.2L氯仿中含有C—Cl键的数目为1.5NA
⑧lmolC15H32分子中含碳碳键数目为14NA
A.①③⑤⑦ B.①②④⑧ C.②③⑥⑧ D.①②⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在生产和科研中有重要应用。
(1)若发生大量氯气泄漏事故,下列措施中正确的是__________。
a. 立即通报相关部门,迅速撤离事故现场
b. 用蘸有NaOH溶液的毛巾捂住口鼻
c. 逆风疏散
d. 顺风疏散
(2)事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是__________。
(3)某学生用下图装置制备氯气并与潮湿的![]() 反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
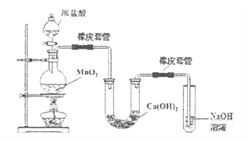
①圆底烧瓶中发生反应的化学方程式是__________。
②此实验结果所得![]() 产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
i温度较高时氯气与![]() 反应生成
反应生成![]() ,为避免此副反应的发生,可采取的措施是___________。
,为避免此副反应的发生,可采取的措施是___________。
ii试判断另一个副反应(写出此反应方程式):___________。为避免此副反应发生,应采取的措施是____________。
(4)在一定量的NaOH溶液中通入一定量![]() ,二者恰好完全反应。生成物中含有
,二者恰好完全反应。生成物中含有![]() 、
、![]() 、
、![]() 三种含氯元素的离子,其中
三种含氯元素的离子,其中![]() 、
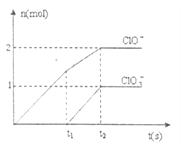
、![]() 两种离子的物质的量(n)与反应时间(t)的曲线如下图所示。则
两种离子的物质的量(n)与反应时间(t)的曲线如下图所示。则![]() 时被氧化的氯元素和被还原的氯元素质量之比为__________。
时被氧化的氯元素和被还原的氯元素质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一,根据该合成路线回答下列问题: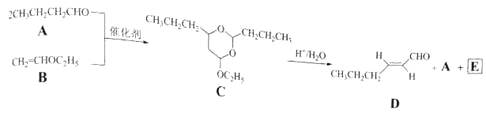
已知 ![]()
![]() RCHO+R′OH+R″OH
RCHO+R′OH+R″OH
(1)A的名称是;B分子中的共面原子数目最多为;C分子中与环相连的三个基团中,不同化学环境的氢原子共有种.
(2)D中含氧官能团的名称是 . 写出检验该官能团的化学反应方程式: .
(3)E为有机物,能发生的反应有:
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整.
(6)问题(5)的合成路线中的第一步反应的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的( )
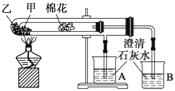
A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
A.提出了元素周期律
B.开发了合成氨的生产工艺
C.揭示了燃烧的本质
D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
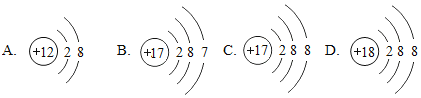
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
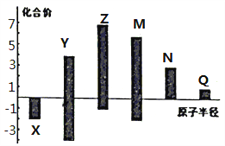
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 :
A.1mol气体的体积主要由微粒的大小决定
B.标准状况下,气体摩尔体积约为22.4L
C.若1molCH4的体积约为22.4L,则一定处于标准状况
D.20℃、101KPa时,气体摩尔体积大于22.4L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com