
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.

科目:高中化学 来源: 题型:
| A、盐酸与氢氧化钠溶液混合:H++OH-=H2O |
| B、氯气通入溴化钠溶液:Cl2+2Br-=Br2+2Cl- |
| C、铜投入氯化铁溶液中:3Cu+2Fe3+=3Cu2++2Fe |
| D、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 称量氢氧化钠固体 |
B、 检验铁粉与水蒸气反应产生的氢气 |
C、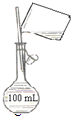 配制150mL 0.10 mol?L-1盐酸 |
D、 分离两种沸点相差较大的液体互溶混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH(开始沉淀) | 2.3 | 7.5 | 5.6 |
| pH(完全沉淀) | 3.9 | 9.7 | 6.4 |
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,合成这种二肽的氨基酸是
,合成这种二肽的氨基酸是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、K+、OH- |
| B、K+、NH4+、OH- |
| C、Na+、Ca2+、HCO3- |
| D、Fe3+、NO3-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com