
 ;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O,故答案为:
;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O,故答案为: ;N2O;
;N2O;

科目:高中化学 来源: 题型:
| A、Fe3O4既可看做是氧化物,又可看做是铁盐 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作.
某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作. | 现象 | 结论 |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液不变色 | |
| ①中酸性KMnO4溶液不褪色 ②中KSCN溶液变红 | |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
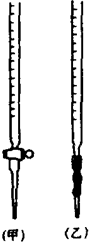 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀.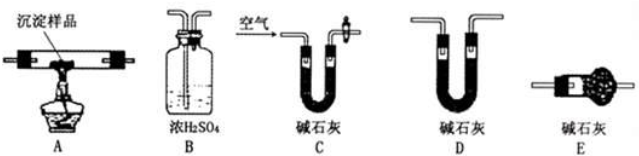
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com