
| A. | 10 g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24 L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 高温下,0.2 mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA | |
| D. | 25℃时,100 mL pH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
分析 A.乙醇溶液中乙醇、水分子都含有氢原子;
B.氯气与水反应为可逆反应,不能进行到底;
C.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2计算;
D.100 mL pH=13的Ba(OH)2溶液中OH-的浓度是0.1 mol•L-1,依据n=CV计算氢氧根离子数目.
解答 解:A.12.10 g 46%的乙醇水溶液中含有C2H5OH 0.1 mol、H2O 0.3 mol,二者含有的氢原子数目的总和是1.2NA,故A正确;
B.氯气溶于水时只有少量Cl2与水发生反应Cl2+H2O?HCl+HClO,所以2.24 L氯气转移的电子数目小于0.1NA,故B错误;
C.高温下,铁与水蒸气发生下列反应:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,0.2 mol铁参加反应生成氢气的分子数目应为$\frac{0.8}{3}$NA,故C错误;
D.100 mL pH=13的Ba(OH)2溶液中OH-的浓度是0.1 mol•L-1,其中含有的OH-数目为0.01NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意氯气与水反应为可逆反应,选项BD为易错选项.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
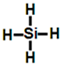 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| B. | 次氯酸分子的电子式: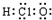 | |
| C. | 乙酸乙酯的结构简式: | |
| D. | Al(OH)3的电离:H++AlO2-+H2O?Al(OH)2?Al3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,请回答以下问题:
,请回答以下问题: .
. .
.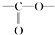 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.
,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
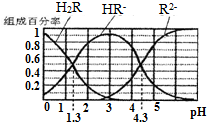 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )| A. | 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在$\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})}$=10-3 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com